СЕМИОТИКА ПОРАЖЕНИЙ ОРГАНОВ ПИЩЕВАРЕНИЯ Заболевания органов пищеварения у детей дошкольного и школьного возраста составляют 79,3 случая на 1000 детей. Удельный вес функциональных нарушений системы пищеварения с возрастом у детей снижается, и одновременно нарастает частота органических заболеваний. Для диагностики заболеваний органов пищеварения важное значение имеет анализ жалоб, знание и учет анатомо-физиологических особенностей желудочно-кишечного тракта ребенка. АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У ДЕТЕЙ. Формирование органов пищеварения начинается с 3—4-й недели эмбрионального периода, когда из энтодермальной пластинки образуется первичная кишка. На переднем конце ее на 4-й неделе возникает ротовое отверстие, а несколько позднее на противоположном конце появляется анальное отверстие. Кишка быстро удлиняется, а с 5-й недели эмбрионального периода кишечная трубка разграничивается на два отдела, являющиеся основой для формирования тонкой и толстой кишок. В этот период начинает выделяться желудок — как расширение первичной кишки. Одновременно идет образование слизистой, мышечной и серозной оболочек желудочно-кишечного тракта, в которых формируются кровеносные и лимфатические сосуды, нервные сплетения, эндокринные клетки. В первые недели беременности у плода закладывается эндокринный аппарат желудочно-кишечного тракта и начинается продукция регуляторных пептидов. В процессе внутриутробного развития нарастает число эндокринных клеток, повышается содержание в них регуляторных пептидов (гастрина, секретина, мотилина, гастрального ингибирующего пептида (ГИП), вазо-активного интестинального пептида (ВИП), энтероглкжагона, соматостатина, нейротензина и др.). Одновременно повышается реактивность органов-мишеней по отношению к регулятор-ным пептидам. Во внутриутробном периоде закладываются периферические и центральные механизмы нервной регуляции деятельности желудочно-кишечного тракта. У плода желудочно-кишечный тракт начинает функционировать уже на 16—20-й неделе внутриутробной жизни. К этому времени выражен глотательный рефлекс, в слюнных железах обнаруживается амилаза, в желудочных — пепсиноген, в тонкой кишке — секретин. Нормальный плод заглатывает большое количество амниотической жидкости, отдельные компоненты которой гидролизуются в кишечнике и всасываются. Не подвергшаяся перевариванию часть содержимого желудка и кишечника идет на образование мекония. Во время внутриутробного развития до имплантации зародыша в стенку матки его питание происходит за счет запасов в цитоплазме яйцеклетки. Эмбрион питается секретами слизистой оболочки матки и материалом желточного мешка (гистотрофный тип питания). Со времени образования плаценты основное значение приобретает гемотрофное (трансплацентарное) питание, обеспечиваемое транспортом питательных веществ из крови матери к плоду через плаценту. Оно играет ведущую роль до рождения ребенка. С 4—5 мес внутриутробного развития начинается деятельность органов пищеварения и совместно с гемотрофным происходит амниотрофное питание. Суточное количество поглощаемой плодом жидкости в последние месяцы беременности может достигать более 1 л. Плод поглощает амниотическую жидкость, содержащую питательные вещества (белки, аминокислоты, глюкозу, витамины, гормоны, соли и др.) и гидролизующие их ферменты. Некоторые ферменты поступают в амниотическую жидкость от плода со слюной и мочой, вторым источником их является плацента, третий источник — организм матери (ферменты через плаценту и минуя ее могут поступать в амниотическую жидкость из крови беременной женщины). Часть питательных веществ всасывается из желудочно-кишечного тракта без предварительного гидролиза (глюкоза, аминокислоты, некоторые димеры, олигомеры и даже полимеры), так как кишечная трубка плода имеет высокую проницаемость, энтероциты плода способны к пиноцитозу. Это важно учитывать при организации питания беременной женщины с целью профилактики аллергических заболеваний. Некоторая часть питательных веществ амниотической жидкости переваривается ее же ферментами, то есть в амниотическом питании плода большую роль играет аутолитический тип пищеварения. Амниотрофное питание типа собственного полостного пищеварения может осуществляться со 2-й половины беременности, когда клетками желудка и поджелудочной железы плода секретируются пепсиноген и липаза, хотя их уровень низкий. Амниотрофное питание и соответствующее ему пищеварение имеют значение не только для поставки питательных веществ в кровь плода, но и как подготовка органов пищеварения к лактотрофному питанию. У новорожденных и детей первых месяцев жизни полость рта относительно мала, язык большой, хорошо развиты мышцы рта и щек, в толще щек имеются жировые тельца (комочки Биша), отличающиеся значительной упругостью в связи с преобладанием в них твердых (насыщенных) жирных кислот. Эти особенности обеспечивают полноценное сосание груди. Слизистая оболочка полости рта нежная, суховатая, богата кровеносными сосудами (легко ранима). Слюнные железы развиты слабо, продуцируют мало слюны (в большей степени функционируют подчелюстная, подъязычная железы у детей грудного возраста, у детей после года и взрослых — околоушная). Активно функционировать слюнные железы начинают к 3—4-му месяцу жизни, но даже в возрасте 1 года объем слюны (150 мл) составляет 1/10 от количества ее у взрослого человека. Ферментативная активность слюны в раннем возрасте составляет 1/3—1/2 от ее активности у взрослых, однако уровня взрослых она достигает в течение 1 —2 лет. Хотя ферментативная активность слюны в раннем возрасте низкая, ее действие на молоко способствует его створаживанию в желудке с образованием мелких хлопьев, что облегчает гидролиз казеина. Гиперсаливация в 3—4-месячном возрасте обусловлена прорезыванием зубов, слюна может вытекать изо рта из-за неумения детей глотать ее. Реакция слюны у детей первого года жизни нейтральная или слабокислая — это может способствовать развитию молочницы слизистой оболочки полости рта при неправильном уходе за ней. В раннем возрасте в слюне низкое содержание лизоцима, секреторного иммуноглобулина А, это обусловливает ее низкую бактерицидность и необходимость соблюдения правильного ухода за полостью рта. Пищевод у детей раннего возраста имеет воронкообразную форму. Длина его у новорожденных составляет 10 см, с возрастом она увеличивается, при этом диаметр пищевода становится больше. В возрасте до года слабо выражены физиологические сужения пищевода, особенно в области кардиального отдела желудка, что способствует частому срыгиванию пищи у детей 1-го года жизни. Желудок у детей грудного возраста расположен горизонтально, дно его и кардиальный отдел развиты слабо, что объясняет склонность детей первого года жизни к срыгиванию и рвоте. По мере того как ребенок начинает ходить, ось желудка становится более вертикальной, и к 7—11 годам он расположен так же, как у взрослого. Емкость желудка у новорожденного составляет 30— 35 мл, к году увеличивается до 250—300 мл, к 8 годам достигает 1000 мл. Секреторный аппарат желудка у детей 1-го года жизни развит недостаточно, в слизистой оболочке желудка у них меньше желез, чем у взрослых, и функциональные способности их низкие. Хотя состав желудочного сока у детей такой же, как у взрослых (соляная кислота, молочная кислота, пепсин, сычужный фермент, липаза), но кислотность и ферментативная активность более низкие, что определяет низкую барьерную функцию желудка и рН желудочного сока (4—5, у взрослых 1,5—2,2). В связи с этим белки недостаточно расщепляются в желудке пепсином, они расщепляются в основном катепсинами и гастриксином, вырабатываемыми слизистой оболочкой желудка, оптимум действия их — при рН 4—5. Липаза желудка (вырабатываемая пилорическим отделом желудка) расщепляет в кислой среде вместе с липазой женского молока до половины жиров женского молока. Эти особенности необходимо учитывать при назначении различных видов питания ребенку. С возрастом секреторная деятельность желудка увеличивается. Моторика желудка у детей первых месяцев жизни замедлена, перистальтика вялая. Сроки эвакуации пищи из желудка зависят от характера вскармливания. Женское молоко задерживается в желудке 2—3 ч, коровье — 3— 4 ч, что свидетельствует о трудностях переваривания последнего. Кишечник у детей относительно длиннее, чем у взрослых. Слепая кишка подвижна из-за длинной брыжейки, аппендикс поэтому может располагаться в правой подвздошной области, смещаться в малый таз и в левую половину живота, что создает трудности в диагностике аппендицита у детей раннего возраста. Сигмовидная кишка относительно длинная, это предрасполагает к запорам у детей, особенно если у матери молоко содержит повышенное количество жира. Прямая кишка у детей первых месяцев жизни также длинная, со слабой фиксацией слизистого и подслизистого слоя, в связи с чем при тенезмах и упорных запорах возможно ее выпадение через анальное отверстие. Брыжейка более длинная и легко растяжимая, что может приводить к перекрутам, инвагинациям и другим патологическим процессам. Возникновению инвагинации у детей раннего возраста способствует и слабость илеоцекальной заслонки. Особенностью кишечника у детей является лучшее развитие циркулярной мускулатуры, чем продольной, что предрасполагает к спазмам кишечника и кишечной колике. Особенностью органов пищеварения у детей является также слабое развитие малого и большого сальника, а это ведет к тому, что инфекционный процесс в брюшной полости (аппендицит и др.) часто ведет к разлитому перитониту. Секреторный аппарат кишечника к моменту рождения ребенка в целом сформирован, в кишечном соке находятся те же ферменты, что и у взрослых (энтерокиназа, щелочная фосфа-таза, липаза, эрипсин, амилаза, мальтаза, лактаза, нуклеаза и др.), но активность их низкая. Под влиянием кишечных ферментов, главным образом поджелудочной железы, происходит расщепление белков, жиров и углеводов. Однако рН сока двенадцатиперстной кишки у детей раннего возраста слабокислый или нейтральный, поэтому расщепление белка трипсином ограничено (для трипсина оптимальный рН — щелочной). Особенно напряженно идет процесс переваривания жиров из-за низкой активности липолитических ферментов. У детей, находящихся на грудном вскармливании, эмульгированные желчью липиды на 50 % расщепляются под влиянием липазы материнского молока. Переваривание углеводов происходит в тонком кишечнике под влиянием амилазы поджелудочной железы и дисахаридаз кишечного сока. Процессы гниения в кишечнике у здоровых детей грудного возраста не происходят. Особенности строения кишечной стенки и большая ее площадь определяют у детей раннего возраста более высокую, чем у взрослых, всасывательную способность и вместе с тем недостаточную барьерную функцию из-за высокой проницаемости слизистой оболочки для токсинов и микробов. Двигательная функция желудочно-кишечного тракта у детей раннего возраста также имеет ряд особенностей. Перистальтическая волна пищевода и механическое раздражение нижнего его отдела пищевым комком вызывают рефлекторное раскрытие входа в желудок. Моторика желудка складывается из перистальтики (ритмические волны сокращения от кардиального отдела до привратника), перистолы (сопротивление, оказываемое стенками желудка растягивающему действию пищи) и колебаний тонуса стенки желудка, которое появляется через 2—3 ч после приема пищи. Моторика тонкого кишечника включает маятникообразное движение (ритмические колебания, которые осуществляют перемешивание кишечного содержимого с кишечным секретом и создают благоприятные условия для всасывания), колебание тонуса кишечной стенки и перистальтику (червеобразные движения по ходу кишечника, содействующие продвижению пищи). В толстом кишечнике отмечаются также маятникообразные и перистальтические движения, а в проксимальных отделах — антиперистальтика, способствующая формированию каловых масс. Время прохождения пищевой кашицы по кишечнику у детей короче, чем у взрослых: у новорожденных — от 4 до 18 ч, у более старших — около суток. Следует отметить, что при искусственном вскармливании этот срок удлиняется. Акт дефекации у грудных детей происходит рефлекторно без участия волевого момента, и лишь к концу первого года жизни дефекация становится произвольной. Новорожденный в первые часы и дни жизни выделяет первородный кал, или меконий, в виде густой массы темно-оливкового цвета без запаха. В дальнейшем испражнения здорового грудного ребенка имеют желтую окраску, кислую реакцию и кисловатый запах, причем консистенция их кашицеобразная. В более старшем возрасте стул становится оформленным. Частота стула у грудных детей — от 1 до 4—5 раз в сутки, у детей старшего возраста — 1 раз в сутки. Кишечник ребенка в первые часы жизни почти свободен от бактерий. В дальнейшем желудочно-кишечный тракт заселяется микрофлорой. В полости рта у грудного ребенка можно обнаружить стафилококки, стрептококки, пневмококки, кишечную палочку и некоторые другие бактерии. В кале появляются кишечные палочки, бифидобактерии, молочнокислые палочки и др. При искусственном и смешанном вскармливании фаза бактериального инфицирования происходит быстрее. Бактерии кишечника способствуют процессам ферментативного переваривания пищи. При естественном вскармливании преобладают бифидобактерии, молочнокислые палочки, в меньшем количестве - кишечная палочка. Кал светло-желтый с кисловатым запахом, мазевидный. При искусственном и смешанном вскармливании в связи с преобладанием процессов гниения в кале много кишечной палочки, бродильная флора (бифидофлора, молочнокислые палочки) имеется в меньшем количестве. Печень у детей относительно большая, у новорожденных она составляет около 4 % массы тела (у взрослых — 2 % массы тела). У детей раннего возраста желчеобразование менее интенсивное, чем у детей более старшего возраста. Желчь детей бедна желчными кислотами, холестерином, лецитином, солями и щелочью, но богата водой, муцином, пигментами и мочевиной, а также больше содержит таурохолевой, чем гликохолевой кислоты. Важно отметить, что таурохолевая кислота является антисептиком. Желчь нейтрализует кислую пищевую кашицу, что делает возможной деятельность поджелудочного и кишечного секретов. Кроме того, желчь активирует панкреатическую липазу, эмульгирует жиры, растворяет жирные кислоты, превращая их в мыла, усиливает перистальтику толстого отдела кишечника. Таким образом, система органов пищеварения у детей отличается рядом анатомо-физиологических особенностей, которые отражаются на функциональной способности этих органов. У ребенка на первом году жизни потребность в пище относительно большая, чем у детей старшего возраста. Хотя у ребенка имеются все необходимые пищеварительные ферменты, функциональная способность органов пищеварения ограничена и может быть достаточной только при условии, если ребенок получает физиологическую пищу, а именно женское молоко. Даже небольшие отклонения в количестве и качестве пищи могут вызвать у грудного ребенка расстройства пищеварения (особенно часты они на 1-м году жизни) и в конечном итоге привести к отставанию физического развития. СЕМИОТИКА ПОРАЖЕНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА. Наиболее распространенными заболеваниями являются хронический гастрит и гастродуоденит, эзофагит, гастроэзофагеальная болезнь. В последнее время увеличилась частота сочетанных поражений желудочно-кишечного тракта, эрозивных гастритов. Наряду с принятым в отечественной литературе термином «функциональные расстройства» в настоящее время используются также термин «неязвенная диспепсия, или пупочная колика» и др. СЕМИОТИКА НАРУШЕНИИ ГЛОТАНИЯ (ДИСФАГИИ). Нормальный транспорт пищевого комка через глотательный канал зависит от размеров комка, диаметра канала, перистальтического сокращения и состояния глотательного центра, который обеспечивает нормальное расслабление верхнего и нижнего сфинктеров пищевода во время глотания и угнетение стойких сокращений в теле пищевода. При поражении пищевода одним из частых симптомов является дисфагия — затруднение или дискомфорт при глотании. Она воспринимается пациентом как ощущение «застревания» при прохождении пищи через полость рта, глотку или пищевод. Дисфагия, вызванная слишком большим размером пищевого комка или сужением просвета глотательного канала, называется механической, а дисфагия, обусловленная некоординированными или слабыми перистальтическими сокращениями или угнетением глотательного центра, — двигательной. Этиология и диагностика дисфагии
Механическая дисфагия может быть вызвана изменением просвета канала (внутренним сужением или наружным сдавлением). У взрослого человека пищевод может растягиваться более чем до 4 см в диаметре благодаря эластичности его стенки. В тех случаях, когда пищевод не в состоянии растянуться до диаметра просвета более 2,5 см, может развиться дисфагия, а когда пищевод не может растянуться до просвета свыше 1,3 см, дисфагия будет обязательно. Двигательная дисфагия может возникнуть вследствие затруднений при инициировании глотания или нарушения перистальтики и угнетения центра глотания, обусловленных заболеваниями гладких или скелетных мышц пищевода. Наиболее важными причинами двигательной дисфагии являются диффузный спазм пищевода и связанные с ним нарушения двигательной функции, паралич глотки, ахалазия, связанная с неосуществлением глотательной функции перстневидно-глоточной мышцей и склеродермией пищевода. Крайней степенью выраженности дисфагии является боль, возникающая при глотании (одинофагия). Часто одинофагия и дисфагия развиваются одновременно. Globus hystericus — это кажущееся ощущение того, что в горле застрял комок. Однако при реальном осуществлении акта глотания не наблюдается никаких затруднений. Фагофобия — страх глотания, а при заболевании истерией, столбняком, бешенством и параличом глотки может возникнуть обусловленный страхом аспирации отказ от глотания. Некоторые больные могут ощущать прохождение пищи по пищеводу, что не связано с застреванием пищи в пищеводе или с его закупоркой. При эзофагеальной дисфагии эти ощущения локализованы ретростернально или у мечевидного отростка, возникают после нескольких последовательных глотательных актов. Орофарингеальная дисфагия сопровождается назальной регургитацией, аспирацией в гортань при кашле (возможно удушье) во время первых глотательных движений (при патологии ротовой полости, гортани, поражении нервной системы). Для функциональной дисфагии характерным является затруднение при глотании жидкой пищи, воды, тогда как твердая пища проходит свободно. Дифференциальная диагностика дисфагии. Анамнез позволяет поставить диагноз у большей части больных. Наличие в анамнезе длительно существующей изжоги и рефлюкса, предшествующих дисфагии, указывает на пептическую стриктуру. Непродолжительная преходящая дисфагия может быть обусловлена воспалительным процессом. Если у больного наблюдается одинофагия, следует предположить наличие у него кандидозного или герпетического эзофагита. Затруднения, возникающие при глотании только твердой пищи, указывают на механическую дисфагию, застрявший комок при этом можно протолкнуть через суженный участок пищевода, выпив какую-либо жидкость. При резко выраженном уменьшении просвета глотательного канала дисфагия развивается при употреблении как твердой, так и жидкой пищи. В отличие от этого двигательная дисфагия, обусловленная ахалазией и диффузным спазмом пищевода, вызывается употреблением как твердой, так и жидкой пищи с самого начала заболевания. Регургитация в нос и трахео-бронхиальная аспирация при глотании являются признаком паралича мышц глотки или наличия трахеопищеводного свища. Трахеобронхиальная аспирация, не связанная с глотанием, может быть вторичной при ахалазии, дивертикуле ценкера или желудочно-пищеводном рефлюксе. В случае если дисфагии предшествует хрипота, первичное поражение обычно локализуется в гортани. Иногда хрипота может быть обусловлена ларингитом, вторичным по отношению к желудочно-пищеводному рефлюксу. Сочетание симптомов поражения гортани и дисфагии наблюдается также при различных нервно-мышечных нарушениях. Икота заставляет предположить поражение дистального отдела пищевода. Боль в области грудной клетки, сочетающаяся с дисфагией, развивается при диффузном спазме пищевода и связанных с ним двигательных нарушениях. Боль в области грудной клетки, сходная с болью, испытываемой при диффузных спазмах пищевода, может возникнуть и при острой афагии, обусловленной слишком большим пищевым комком. При объективном обследовании следует тщательно проверить, нет ли в дополнение к симптоматике генерализованного нервно-мышечного заболевания признаков бульбарного или псевдобульбарного паралича, к которым относятся дизартрия, дисфония, птоз, атрофия языка, гиперактивные сокращения челюстных мышц. При обследовании полости рта и глотки можно выявить поражения, которые препятствуют прохождению пищи из полости рта в пищевод из-за болей или обструкции. Необходимо обследование области шеи, чтобы убедиться в том, что отсутствуют увеличение щитовидной железы или спинальные нарушения. При наличии изменений на коже или конечностях следует предположить диагноз склеродермии и других коллагеновых заболеваний. Больные с дисфагией подвергаются тщательному инструментальному исследованию. Им проводятся эзофагогастроскопия с биопсией слизистой оболочки и цитологическим исследованием, оценка сократительной способности пищевода, реже — рентгеноскопия пищевода с контрастированием бариевой взвесью. СЕМИОТИКА ИЗМЕНЕНИЙ АППЕТИТА. Аппетит — очень широкий и универсальный критерий состояния здоровья ребенка. Чаще жалуются на понижение, чем на повышение аппетита. Оба эти состояния требуют одинакового внимания. В норме процесс принятия пищи регулируется двумя гипоталамическими центрами: боковым «центром голода» и вентромедиальным «центром насыщения». Последний угнетает «центр голода» после приема пищи, что приводит к появлению чувства сытости. Пептид холецистокинин вызывает эффект насыщения и участвует в регуляции пищевого поведения. Гипертонус желудочных мышц ведет к возрастанию аппетита, гипотония — к его снижению. Одними из самых частых жалоб родителей являются отсутствие аппетита у детей, плохой аппетит или капризы в еде. Анорексия (anorexis) — нежелание или отказ от приема пищи, снижение аппетита (hyporexis). Ее не следует смешивать с ситофобией — боязнью приема пищи из-за возникающих при этом болей или сопутствующего еде чувства дискомфорта. Ситофобия является классическим симптомом при язве желудка, регионарном энтерите или ишемии кишечника. Жалобы родителей на плохой аппетит у ребенка всегда требуют критического отношения. Если ребенок хорошо развивается, нормально упитан, активен физически и психически, хорошо переносит нагрузки, здоров, то снижение аппетита у него связано не с какими-либо органическими нарушениями, а, скорее всего, с психогенными воздействиями, чаще с конфликтами между матерью и ребенком. Анорексия развивается при многих заболеваниях и поэтому сама по себе не имеет большой диагностической ценности. Однако длительные нарушения аппетита имеют существенное значение для диагностики при сопоставлении этого симптома с другими данными. Анорексия у новорржденных часто наблюдается при перинатальных поражениях центральной нервной системы, при аминоацидуриях, интоксикации при общих заболеваниях (пневмонии, сепсисе, пиелонефрите, отите и др.), у ослабленных и недоношенных детей, при врожденных дефектах полости рта. У детей 1-го года жизни снижение аппетита (отказ от груди) возникает в начале острых заболеваний (пневмонии, кишечные инфекции и др.), при кишечном дисбактериозе, железодефицит-ной анемии, гипервитаминозе D, нервно-артритическом диатезе, отите и др. У детей дошкольного и школьного возраста снижение аппетита развивается при однообразном питании и гиповитамино-зах, острых и хронических инфекциях, тяжелых анемиях, эндокринных дисфункциях, интоксикациях, нервно-артритическом диатезе, недостатке движений и др. Значительна частота невротической формы анорексии, формирующейся при насильственном кормлении. Попытка насильственно накормить ребенка, чтобы восстановить массу тела после перенесенного заболевания, закрепляет отрицательный условный рефлекс. Аппетит у ребенка может снижаться вследствие волнения перед посещением детского сада или школы, приема перед едой сладостей или чрезмерного количества молока в качестве питья, а также кормления ребенка, увлеченного игрой. Изменение аппетита может быть избирательным при непереносимости фруктозы (дети отказываются от фруктов, сладостей, содержащих большое количество фруктозы). Повышенный аппетит (hyperorexis), полифагия (polys — много, phagein — поедать) или «волчий аппетит»— булимия (bus — бык, limos — голод) заставляют обращаться к врачу лишь при необычно большой прибавке массы тела ребенка, поскольку родители всегда рады повышенному аппетиту у него и расценивают это как проявление здоровья, следует учитывать традиции, когда в семье все полные и много едят. Органическими причинами повышенного аппетита у детей чаще бывают сахарный диабет, хронический панкреатит, тиреотоксикоз. Булимия может быть результатом массивной кортикостероидной терапии. Воспалительные поражения ствола мозга, остаточные явления энцефалита могут вести к булимии, которая при этом связана со слабоумием и нередко с несахарным диабетом. Гельминтозы, особенно поражение ленточными глистами, часто сопровождаются повышенным аппетитом. Развитию булимии могут способствовать нарушения внутрисемейных отношений — конфликт между матерью и ребенком, кажущаяся или действительная его заброшенность, лишение ласки, — когда ребенок находит замену положительным эмоциям в еде. Извращенный аппетит (paraorexis) — патологическое влечение к несъедобным веществам, таким как земля, штукатурка, бумага, уголь и др., — наблюдается у дебильных, заброшенных детей и при невропатии. Извращения вкуса могут указывать на железодефицитное состояние из-за однообразного молочно-муч-нистого питания. СЕМИОТИКА ДИСПЕПТИЧЕСКИХ РАССТРОЙСТВ. Тошнота — это неприятное, болезненное субъективное ощущение, предшествующее рвоте или сопутствующее ей. Она обычно связана с пониженной функциональной активностью желудка и изменениями двигательной функции двенадцатиперстной и тонкой кишок. Тошнота возникает при повышении интрадуоденаль-ного давления, особенно свойственна поэтому заболеваниям двенадцатиперстной кишки: дуодениту, гастродуодениту, язвенной болезни двенадцатиперстной кишки. Сопутствующая рвоте тошнота сопровождается изменениями активности вегетативной нервной системы (особенно парасимпатической): бледностью кожных покровов, повышенным потоотделением, обильным выделением слюны, слабостью, головокружением, шумом в ушах, часто гипотензией и брадикардией (вазовагальный синдром). Рвота (vomitus) — это рефлекторный акт выталкивания содержимого желудка через рот. Рвотный акт контролируется двумя функционально различными центрами в продолговатом мозге: рвотным центром и хеморецепторной триггерной зоной, которая сама по себе не способна опосредовать рвотный акт, но активация ее ведет к посылу эффективных импульсов к расположенному в продолговатом мозге рвотному центру, который в свою очередь вызывает рвотный акт. Оба эти центра расположены поблизости друг от друга и от других центров ствола мозга, регулирующих вазомоторные и вегетативные функции. Афферентные сигналы рвотный центр получает от кишечника и других органов, из вышерасположенных кортикальных центров, особенно из аппарата внутреннего уха, и из триггерной зоны. Важными эфферентными проводящими путями при рвоте являются диафрагмальные нервы (к диафрагме), спинномозговые нервы (к мышцам брюшной стенки) и висцеральные эфферентные нервы (к желудку и пищеводу). Рвота является заключительной стадией физиологического акта с вовлечением симпатической и вегетативной нервных систем, глотки, желудочно-кишечного тракта и скелетной мускулатуры грудной клетки и брюшной полости. Начало рвотных движений сопровождается слабостью, бледностью, потоотделением, брадикардией и снижением артериального давления. Происходит глубокий вдох, опускается надгортанник и поднимается гортань, что предохраняет дыхательные пути от попадания в них рвотных масс. В акте рвоты важную роль играет сокращение диафрагмы и мышц передней стенки живота, которое сопровождается антиперистальтическими сокращениями мышц желудка при закрытом привратнике. Заболевания практически любой системы, особенно головного мозга, могут сопровождаться рвотой. В зависимости от механизма возникновения различаются несколько видов рвоты. Центральная (мозговая, нервная) рвота. Заболевания нервной системы (отек головного мозга, обусловленный воспалением, гипоксемией, травмой, острой гидроцефалией, опухолями и т.д.), которые приводят к повышению внутричерепного давления, могут сопровождаться рвотой. Повреждения аппарата внутреннего уха и его центральных связей также часто сопровождаются тошнотой и рвотой. Мозговая рвота обычно развивается вне связи с едой, ей не предшествует тошнота, она не улучшает состояния больного, рвотные массы скудные, без запаха. В клинической картине преобладают головные боли, нарушения зрения и сознания; заболевания желудочно-кишечного тракта отсутствуют. Гематотоксическая рвота возникает при печеночной и почечной недостаточности, болезнях обмена (галактоземия, ацетонемическая рвота, диабетическая прекома и др.), дигиталис-ной интоксикации, гипервитаминозе D, при острых отравлениях и др. Висцеральная, или собственно рефлекторная, — это пищеводная, желудочная, кишечная рвота. Пищеводная рвота (в отличие от истинной рвоты и срыгиваний) — выброс пищи и жидкости, не дошедших до желудка, что наблюдается при врожденной атрезии пищевода, врожденном или приобретенном стенозах пищевода, дивертикулах его, ахалазии. Рвота возникает сразу после еды, рвотные массы при этом без кислого запаха (не имеющие контакта с желудочным соком), необъемные, состоят из непереваренной пищи. Желудочная рвота возникает чаще на фоне заболеваний желудка. Рвоте при острых и хронических гастритах, гастродуоденитах, язвенной болезни, кишечных инфекциях и пищевых ток-сикоинфекдиях обычно предшествует тошнота, что отличает ее от рвоты, обусловленной раздражением рвотного центра. Она обычно связана с едой, приносит временное облегчение ребенку. Для рвотных масс, поступающих из желудка, характерен кислый запах. В рвотных массах обнаруживаются остатки непереваренной пищи, слизь, кровь (цвет кофейной гущи). Рвота, не приносящая облегчения, свойственна заболеваниям гепатобилиарной системы и поджелудочной железы. Примесь желчи в рвотных массах отмечается при всех упорных рвотах, независимо от причин, их вызывающих. Чаще способствует ее появлению дуодено-гастральный рефлюкс. Врожденные механические препятствия в двенадцатиперстной кишке (внутренний стеноз просвета кишки, атрезия двенадцатиперстной кишки, анулярная поджелудочная железа и др.), в отличие от пилоростеноза, ведут к появлению рвоты с примесью желчи на 4—5-й день после рождения. Рвотный акт, если он упорный и сильный, вследствие высокого давления может привести к разрыву пищевода (синдром Бурхаве) или линейным разрывам слизистой оболочки кардиального отдела желудка, что вызывает желудочное кровотечение (синдром Маллори-Вейсса). У детей первых месяцев жизни может быть рвота «фонтаном». Это типичный признак пилоростеноза, являющийся показанием для более детального исследования (УЗИ желудка, рентгеноскопия с контрастным веществом). При стенозе привратника объем рвотных масс больше количества принятой пищи, с гнилостным запахом, в них не бывает примеси желчи. При мегадуо-денуме, наоборот, в рвотных массах содержится примесь желчи. При пилороспазме отмечается многократная рвота небольшим количеством съеденной пищи. Этиологические причины рвоты и их диагностика у детей до 1 года
Разновидностью рвоты у детей первого года жизни является срыгивание, которое возникает без усилия, то есть без напряжения брюшного пресса. Извержение желудочного содержимого при этом не отражается ни на поведении ребенка, ни на его настроении, независимо от объема, степени переваренности пищи, времени, прошедшего после кормления, и силы извержения. Именно эта реакция служит дифференциально-диагностическим различием между срыгиванием и рвотой; у маленького ребенка тошнота, предшествующая рвоте, может проявляться беспокойством, высовыванием языка, чередующимися покраснением и побледнением кожи лица. Срыгивание может быть признаком начала кишечной инфекции, часто срыгивания наблюдаются у здоровых детей. Срыгивание может быть искусственно спровоцировано резкими и нерациональными перемещениями ребенка после приема пищи, укачиванием, неловким надавливанием на эпигастральную область. Более детальное исследование позволяет исключить также «короткий» пищевод, ахалазию кардии. Кишечная рвота наблюдается при непроходимости кишечника (инвагинация, заворот, опухоли и т. д.). Рвота многократная, упорная, с каловым запахом (кишечного содержимого), сопровождается задержкой кала и газов. Ей предшествуют схваткообразные боли в животе. Кровавая рвота (гематемезис) чаще всего возникает при повреждении крупного сосуда при гастродуоденальных эрозиях и язвах, эзофагите, опухоли желудка, из расширенных вен пищевода и желудка при портальной гипертензии, геморрагических диатезах, лейкозе, сепсисе, ожогах слизистой оболочки желудка, синдроме Маллори-Вейсса, гемангиоме и др. Цвет крови в рвотных массах варьирует в зависимости от концентрации соляной кислоты в желудке и ее перемешивания с кровью. Если рвота происходит не в момент кровотечения, а через небольшой промежуток времени, в течение которого кровь смешивается с желудочным содержимым (соляной кислотой), рвотные массы приобретают цвет кофейной гущи из-за солянокислого гематина. Обильная кровавая рвота после завтрака или в середине ночи, нередко с темно-красными сгустками, является симптомом варикозного расширения вен пищевода и кардиального отдела желудка. Кровь, попадающая в желудочно-кишечный тракт ниже двенадцатиперстной кишки, редко оказывается в желудке. Примесь крови к рвотным массам может быть обусловлена кровью, насасываемой ребенком при наличии трещин соска материнской груди или заглатываемой при носовых и других кровотечениях в верхних отделах носоглотки. Для однократного появления каловых масс черного цвета необходимо приблизительно 60 мл крови, острая кровопотеря, при которой выделяется большее количество крови, может вызвать мелену на протяжении 3 сут. После нормализации окраски каловых масс тест на скрытую кровь может оставаться положительным в течение 1 нед и более. В физиологическом отношении рвота является защитной реакцией пищеварительной системы, освобождает желудок от недоброкачественной пищи или токсических веществ. Вместе с тем длительная неукротимая рвота ведет к потере организмом воды и электролитов, в результате чего развиваются обезвоживание и хлорпеническая кома с явлениями алкалоза, а в хронических случаях — истощение организма. Клиническая характеристика примесей крови в рвотных массах (гематемезис)
Регургитация— возврат пищи из желудка в ротовую полость без характерных для рвоты признаков. Она часто наблюдается при гастроэзофагеальном рефлюксе, при механическом или функциональном (ахалазия) сужении пищевода. Руминация — это повторная непроизвольная регургитация недавно съеденной пищи, которая либо выплевывается, либо снова глотается. Этот цикл может продолжаться несколько раз в течение часа после приема пищи и обычно прекращается после появления кислого привкуса во рту. Дети делают это с видимым удовольствием, производя движения нижней челюстью, языком, напоминающие жевания, заканчивая этот акт глотательным движением. Нередко они производят подобную регургитацию произвольно, засовывая пальцы глубоко в рот. Подобное явление бывает у умственно отсталых детей, детей Дома грудного ребенка, детей невропатической конституции, при явно недостаточной воспитательной работе. Срыгивание и рвота относятся к частым проявлением нарушений функции желудочно-кишечного тракта у детей. Диагностика функциональных причин рвоты не представляет трудностей при наличии клинических симптомов основного заболевания. Для дифференциальной диагностики рвоты органического генеза наряду с тщательно собранным анамнезом и данными объективного исследования требуются дополнительные специальные исследования (эндоскопия, методы радионуклидной диагностики, ангиография, компьютерная томография и др.). Синдром диспепсии. Одним из основных синдромов патологии верхних отделов желудочно-кишечного тракта у детей является синдром желудочной диспепсии. Диспепсия (расстройство пищеварения) — наличие абдоминальных болей или дискомфорта в верхней части живота, при этом могут быть и другие симптомы (тошнота, изжога, отрыжка, чувство насыщения и переполнения, вздутие живота и др.). Симптомы могут быть связаны с приемом пищи или не зависеть от него. Термин «хроническая диспепсия», по OMGE, используется, если симптомы отмечаются в течение 3 и более месяцев. Основными признаками, указывающими на наличие диспепсии, являются: абдоминальная боль или дискомфорт, чувство переполнения после приема пищи, вздутие живота, отрыжка, раннее ощущение насыщения, анорексия, тошнота, рвота, изжога, регургитация. Различаются органическая и неорганическая диспепсии. Критериями диагностики органической диспепсии являются: а) клинические данные — язва желудка или двенадцатиперстной кишки, гастроэзофагеальная рефлюксная болезнь, панкреатит, билиарная патология, опухоли желудка, кишечника, употребление лекарственных препаратов, алкоголя и др.; Функциональная (идиопатическая) диспепсия, по OMGE, — это абдоминальная (в верхней части) или ретростернальная боль, дискомфорт, изжога, тошнота, рвота или другие симптомы, указывающие на вовлечение в процесс проксимальных отделов желудочно-кишечного тракта и продолжающиеся не менее 4 нед. При этом не отмечается четкой связи указанных проявлений с физической нагрузкой или имеющимися заболеваниями. В клинической практике для каждой формы диспепсии принято выделять определенный комплекс характерных симптомов. Однако вследствие тесной функциональной взаимосвязи органов пищеварения у конкретного ребенка не всегда удается разграничить клинические признаки этих форм диспепсий. Наиболее типичными проявлениями основных вариантов диспепсий являются: - рефлюксной — изжога, отрыжка кислым; Для пищеводной диспепсии характерны ретростернальная боль или дискомфорт при глотании, изжога и регургитация. Одним из функциональных расстройств желудка является моторная диспепсия, вызванная изменениями его перистальтики (гипер- или гипокинезия) и (или) мышечного тонуса (гипер-или гипотония), ускоряющая или задерживающая эвакуацию желудочного содержимого и проявляющаяся болью, изжогой, отрыжкой, тошнотой и рвотой. Она может быть первичной (самостоятельной) или вторичной (вследствие других заболеваний). В основе моторной диспепсии может лежать ряд причин, прежде всего — алиментарные причины (нарушение режима питания, употребление острой, раздражающей и сокогонной пищи), которые приводят к нарушению периодической деятельности гастродуоденальной системы из-за хаотичной избыточной стимуляции секреции и моторики желудка и двенадцатиперстной кишки. Заболевания органов пищеварения (панкреатит, холецистит и др.) и других внутренних органов (органов дыхания, почек и др.) способствуют моторным нарушениям вследствие вйсцеро-висцеральных рефлексов, токсических влияний и тестинальных гормональных расстройств (нарушение ритмичности в выделении секретина, холецистокинина, панкреозимина и др.). Они могут вызываться также функциональными или органическими изменениями ЦНС. Гипертония желудка наблюдается при грубой пищевой погрешности (холодная котлета наспех); гипотония, как правило, — после длительного стаза у ребенка с дис-мезенхимозом, при спазме или стенозе привратника. Частыми нарушениями моторики желудка являются перегиб желудка (например, при каскадном желудке), пилороспазм или пилоростеноз, недостаточность сфинктера привратника. Изжога — ощущение жара или жжения по ходу пищевода, в загрудинной области — наблюдается при гастродуоденальном рефлюксе, эзофагите и обусловлена забросом в пищевод кислого содержимого желудка. Усиление изжоги при надавливании на эпигастральную область свойственно эзофагиту на фоне недостаточности кардии и грыжи пищеводного отверстия пищевода. Отрыжка — непроизвольное выделение в полость рта газа из желудка или пищевода, иногда с небольшими порциями содержимого желудка. Отрыжка возникает вследствие интрагастраль-ного давления на фоне недостаточности кардиального сфинктера. Она наблюдается при эзофагите и гастродуоденальной патологии (грыжа пищеводного отверстия диафрагмы, недостаточность кардии, эзофагит, гастродуоденит). У детей первого года жизни вследствие недостаточного развития кардиального сфинктера часто наблюдается отрыжка воздухом (аэрофагия), что обусловлено нарушениями кормления (галакторея, широкие отверстия в соске и др.). Метеоризм и флатуленция. Известно, что через пищеварительный тракт здоровых людей каждые сутки проходит значительное количество газов, и это воспринимается как естественный процесс. Скопление большого количества газов может быть вызвано аэрофагией, образованием большого количества газов в кишечнике при дисбактериозах, употреблении углеводов (капусты, бобовых), нарушении всасывания газов в кишечнике (при заболеваниях сердца, циррозе печени и др.), неполной или полной непроходимости кишечника. Первоначальным нарушением, вызывающим функциональное вздутие живота и боль, по мнению некоторых авторов, является нарушение двигательной активности кишечника, которое приводит к тому, что больной ощущает боль при таком объеме кишечного газа, который спокойно переносится здоровыми людьми. У здорового человека при переваривании пищи образуется около 15 л газа, большая часть которого всасывается слизистой оболочкой кишечника, а около 2 л выделяется наружу. В норме основными газами, образующимися преимущественно в толстом кишечнике, являются углекислый газ и водород в дополнение к незначительному количеству зловонных газов, которые придают выделяемым из кишечника газам их характерный запах. В верхних отделах тонкого кишечника также происходит образование СО2, когда соляная кислота из желудка или поступившие с пищей жирные кислоты нейтрализуются бикарбонатом. Приблизительно от 20 до 60 % газа, находящегося в кишечнике, приходится на долю заглатываемого воздуха. Выявление азота и кислорода при хроматогра-фическом исследовании полученного из кишечника газа указывает на то, что источником их проникновения туда должен быть заглатываемый воздух. Повышенное газообразование в кишечнике наблюдается после употребления определенных пищевых продуктов, таких как капуста, бобовые, ржаной или отрубной хлеб, некоторые крупы, при нарушении всасывания углеводов (лактозы, сахарозы), патологической бактериальной колонизации тонкого кишечника или инфицировании ее Lamblia intestinalis. Флатуленция (выделение газов) наступает при запорах, сопровождаемых гнилостной ферментацией. Чаще газы выходят во время дефекации. Сознательное выделение газов указывает на то, что они скапливаются в большом количестве в толстой кишке. Лечение метеоризма обычно направлено на облегчение дискомфорта, ощущаемого больным, и состоит из мер, имеющих целью снизить аэрофагию, в сочетании с ограничением употребления пищевых продуктов, вызывающих повышенное газообразование в кишечнике. Изменения стула. Одной из частых жалоб у детей являются изменения стула. У здорового ребенка в возрасте 1,5—2 лет континенция обеспечивается прежде всего состоянием наружного и внутреннего анальных сфинктеров и пуборектальной петли. Недержание кала означает отсутствие рефлекса к дефекации, неумение управлять этим рефлексом. Произвольный акт дефекации осуществляется при участии центров продолговатого мозга, гипоталамуса и коры больших полушарий головного мозга и вырабатывается в течение первого года жизни. В осуществлении позывов на дефекацию участвуют центры поясничного и крестцового (Sj—S4) отделов спинного мозга (примитивные центры). Наряду с этими примитивными центрами в осуществлении дефекации принимает участие кора головного мозга. В области дна IV желудочка в продолговатом мозге вблизи рвотного и дыхательного центров находится и центр дефекации, участвующий главным образом в осуществлении императивных позывов на низ. Близостью центров объясняются усиление дыхания и торможение рвотного рефлекса при растяжении анальных сфинктеров и непроизвольная дефекация при остановке дыхания. Другие отделы мозга также влияют на процесс дефекации. Еще один центр локализуется в области вароли-ева моста (мост головного мозга). Поэтому ослабление позывов на низ может возникнуть вследствие различных психических воздействий. Дефекация как рефлекторный акт, в свою очередь, оказывает ряд рефлекторных влияний на различные органы и системы. В частности, рефлекторное влияние на сердечно-сосудистую систему проявляется в том, что максимальное артериальное давление повышается на 40—60 мм рт.ст., минимальное — на 10—20 мм рт.ст., а пульс учащается на 20 ударов в минуту. Дефекационный рефлекс возбуждается раздражением рецепторов прямой кишки при ее заполнении каловыми массами и повышении давления в ней до 40—50 мм рт.ст. (3,92—4,90 кПа). В тех случаях, когда супраспинальные центры позволяют этому процессу прогрессировать, сокращения прямой и сигмовидной кишок будут увеличивать давление в прямой кишке и сглаживать ректосигмальный угол. Сопутствующее этому расслабление внутреннего и наружного анальных сфинктеров позволяет осуществить эвакуацию каловых масс (как внутренний, так и наружный сфинктеры вне дефекации находятся в состоянии тонического сокращения, что препятствует выпадению каловых масс). Этот процесс может быть усилен посредством увеличения внутрибрюшного давления (до 220 см вод. ст.) при помощи приема Вальсальвы. И наоборот, дефекацию можно предотвратить сознательно при помощи умышленного сокращения поперечнополосатых мышц тазовой диафрагмы и наружного анального сфинктера. Однако способность подавлять позыв на дефекацию может привести в случае злоупотребления ею к хроническому растяжению прямой кишки, снижению афферентных сигналов, вялому тонусу и хроническому запору. Полифекалия. У детей количество кала превышает 2 % съеденной пищи и выпитой жидкости. Следует учитывать, что количество кала с возрастом увеличивается, составляя в среднем в 1-3 года 92,2 г; в 4-7 лет - 118, в 8-11 лет - 153, в 12-14 лет -157 г в сутки. Количество экскрементов у детей 1-го года жизни относительно больше, чем у более старших детей и взрослых. Суточное количество кала у грудных детей, вскармливаемых женским молоком, небольшое, в среднем 20—25 г, что составляет по весу около 2,5 % принятой пищи. При смешанном и искусственном вскармливании количество каловых масс значительно увеличивается (при смешанном вскармливании до 60 г, при искусственном — до 100 г). Полифекалия характерна прежде всего для синдрома маль-абсорбции. Так, при дисахаридазной недостаточности характерен жидкий пенистый кал без патологических примесей, резко-кислой реакции (рН менее 6). При целиакии фекалии гомогенны, без патологических примесей, светло-желтого цвета, как опара. Непереносимость белков коровьего молока обычно наблюдается у детей 1-го года жизни и клинически проявляется признаками атопического дерматита и целиакоподобным синдромом. Полифекалия и расстройства стула при хронических панкреатитах обусловлены нарушением топографии полостного и мембранного пищеварения вследствие ферментативной недостаточности. Голодный стул напоминает диспептический, но обычно гуще, темнее, может содержать примесь слизи. Иногда голодный стул бывает крошковидным. При простой диспепсии стул жидкий, содержит примесь зелени (из-за быстрого транзита по кишечнику примеси биливердина) и белых комочков (большое количество кальциевых мыл), кисловатого запаха, часто пенистый (бродильная диспепсия). Мыльно-известковый стул характеризуется серовато-белым цветом, сухостью, оформленный, зловонный, имеет щелочную реакцию. Он содержит повышенное количество кальция, магния, свободные жирные кислоты и нейтральный жир. Мыльный стул указывает на гниение в толстом кишечнике, он наблюдается у грудных детей при злоупотреблении коровьим молоком. Нейропатический понос — регулярный понос при психической нагрузке (испуге, острых реакциях страха, отъезде родителей и др.), при этом часто анамнез свидетельствует о семейной предрасположенности к подобным явлениям. Подтверждением диагноза является положительное действие седативных и холи-ноблокирующих препаратов. Основные копрологические синдромы приведены в табл. Запор — длительная (более 48 ч) задержка опорожнения кишечника, сопровождающаяся затруднением акта дефекации, а также малым количеством (менее 100 г в сутки) или повышенной твердостью фекалий, чувством неполного опорожнения кишечника. Запор может быть органического и функционального характера. Наиболее частыми причинами его являются: 1) дефекты питания, недоедание, однообразное молочное питание, отсутствие в рационе старших детей продуктов, дающих значительное количество пищевых шлаков; Копрологические синдромы
Причины запоров
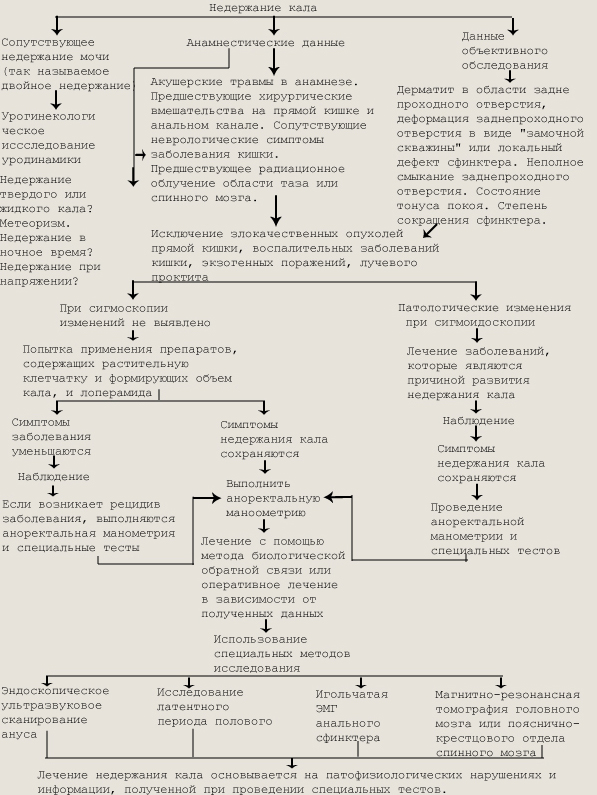
Наиболее часто у детей наблюдаются алиментарные запоры, которые связаны с редким приемом и малым объемом пищи при плохом аппетите, с употреблением пищи, бедной клетчаткой (особенно при повышенной жирности молока матери), высоким содержанием в пище белков и животных жиров, недостаточным поступлением в кишечник витаминов, солей кальция и др. Если стула не бывает несколько дней у детей с рождения, следует думать о врожденных аномалиях развития кишечника (мегаколоне, болезни Гиршпрунга, мегасигме и др.). У грудных детей кроме приведенных заболеваний запор бывает при гипотиреозе, гиперпаратиреозе, тубулопатиях, гипервитаминозе D, гипокалиемии, нарушении диеты и др. У детей старшего возраста запор отмечается при гипотиреозе, колитах, долихоколоне, мегаколоне. К запору ведут механические препятствия, прием лекарств (атропиноподобных, катехоламинов), феохромоцитома, алиментарные причины. Среди функциональных запоров чаще всего встречаются спастический или гипокинетический запоры (имеется в виду функциональное нарушение пассажа кала через толстый кишечник). Возникновению гипермоторной дискинезии чаще способствуют паразитирование гельминтов и лямблий, кишечный дисбактериоз. Стул при гипермоторной дискинезии - в виде плотных отдельных комочков или «овечьего» кала, дети жалуются на схваткообразные боли в животе. Дискинетические запоры гипомоторного типа наблюдаются у детей астенического телосложения с дефицитом массы тела, у которых часто выявляются гастро- и энтероптоз, а также при заболеваниях, для которых характерна мышечная гипотония: болезни Дауна, миопатии, склеродермии, микседеме, гипотиреозе, рахите и др. При гипомоторной дискинезии отмечается увеличение диаметра каловых масс (каловые массы заполняют вялый растянутый кишечник), боли в животе нерезко выраженные, ноющие. В результате всасывания продуктов гниения из кишечника при хронических запорах у детей нарушается самочувствие: появляются повышенная утомляемость, головные боли, снижается аппетит, ухудшается сон. Условнорефлекторные запоры появляются у ребенка в результате изменения привычного образа жизни: с началом посещения детского сада, школы, когда смещается обычное время дефекации. В возникновении психогенных запоров имеют значение такие факторы, как длительные и частые стрессовые ситуации в семье, школе, чрезмерные эмоциональные и умственные нагрузки с одновременной гиподинамией. Психогенные факторы, приводящие к невротически обусловленному запору, могут сформировать картину как паралича толстой кишки, так и ее спазма с типичным «овечьим» калом. Запоры могут возникать по типу висцеро-висцеральных рефлексов при заболеваниях органов пищеварения, мочеполовой системы, поражениях головного и спинного мозга, психических заболеваниях. При острой задержке стула следует заподозрить механическую или паралитическую кишечную непроходимость. Диагноз запора основывается на данных анамнеза (боли в животе, снижение аппетита, задержка стула на несколько дней, отхождение плотного кала, прием лекарств и т. д.), пальцевого исследования ануса и прямой кишки, колоноскопии, ирригоскопии. Недержание кала (энкопрез) — функциональное расстройство дефекации, при котором имеется нарушение функции прямой кишки и наружного или внутреннего сфинктеров заднепроходного отверстия, проявляющееся непроизвольной дефекацией. Причины, приводящие к энкопрезу, разнообразны. Чаще различаются приобретенная и врожденная формы недержания кала. Врожденная форма энкопреза наблюдается при спинномозговых грыжах, опухолях, эктопии анального канала, последствиях промежностной или брюшно-промежностной про-ктопластики. Пр иобретенная форма энкопреза (функциональный энкопрез) может быть обусловлена нейрогенными и сенсорными, психогенными (функциональный мегаколон), мышечными или моторными (перелом костей таза, ранение, некротический парапроктит и др.) причинами. При этом могут иметь место повреждение наружного и внутреннего анальных сфинктеров, пуборектальной мышцы, нарушение координации наружного и внутреннего сфинктеров, отсутствие или повреждение всех сфинктеров. Функциональный энкопрез у детей может быть истинным (дневные, ночные, смешанные формы), причиной которого является нарушение деятельности сфинктерного аппарата прямой кишки под влиянием явных или скрытых, однократных или длительно действующих психических эффектов, и ложным, оп-стипационным (парадоксальное недержание кала), обусловленным снижением чувствительности рецепторов прямой кишки при хроническом застое содержимого в толстом кишечнике и переполнением дистальных отделов последнего. Первопричиной функционального энкопреза является временный запор, вызываемый различными причинами (см. ранее). Временный запор приводит к формированию крупной фекало-мы, вторичному расширению прямой кишки, исчезновению позыва на акт дефекации. Запор становится стойким, расширяется верхний отдел анального канала вместе с внутренним сфинктером и пуборектальной петлей. Жидкий кал, обтекая фекалому, не контролируется сфинктерным аппаратом, в результате возникает недержание кала. Клинически недержание кала, независимо от причины, проявляется однотипно: сухой и чистоплотный ребенок начинает непроизвольно терять большее или меньшее количество каловых масс. Эти явления могут возникнуть остро, развиваться быстро и заканчиваться выздоровлением в течение короткого времени или развиваться медленно и неуклонно прогрессировать. Ребенок ежедневно и постоянно пачкает белье, от него исходит неприятный запах. Острое недержание кала наблюдается при остром воспалении кишечника, тяжелых заболеваниях с потерей сознания, при большом эпилептическом припадке, сильном аффекте страха и испуга. Диагностика причин энкопреза основывается на данных анамнеза, осмотра (определяются величина заднепроходного отверстия, его форма, изменения в перианальной и ягодичной областях), исследования ануса и прямой кишки (анальный рефлекс, тонус и волевое сокращение анального сфинктера), ректороманоскопии, сфинктерометрии (оценивается сила анального жома), электромиографии (сохранность мышечной ткани и ее иннервация), дилатометрии (растяжимость анального кольца), рентгенологического исследования (для исключения поражений позвоночника, костей таза). Понос (диарея) — учащенное опорожнение кишечника с выделением разжиженных, а в некоторых случаях и обильных испражнений. Причина в любом случае заключается в нарушении процессов переваривания, всасывания и транспорта в кишечнике основных нутриентов. Принято выделять четыре типа диареи: осмотический, секреторный, моторный и экссудативный.
Алгоритм обследования пациентов с недержанием кала Патогенез диарей
Для осмотического типа диареи характерно увеличение осмотического давления в полости кишечника. Наблюдается при нарушении переваривания и всасывания углеводов (дисахаридазная недостаточность: лактазная и сахаразная; целиакия — непереносимость белка глиадина), непереносимости белков коровьего молока, а также при повышенном поступлении в кишечник осмотически активных веществ. Слизистая оболочка кишечника свободно проницаема для воды и электролитов, поэтому устанавливается равновесие между плазмой и тонкой кишкой, а так как в толстом кишечнике активно задерживается натрий, то при осмотической диарее потери калия выше, чем натрия. Экссуд ативная диарея характерна для воспалительных заболеваний толстой кишки, дивертикулеза, инвазивных инфекций (дизентерии, сальмонеллеза и др.), экссудативной энтеропатии (лимфангиэктазии кишечника). При инвазивных диареях в большинстве случаев происходит размножение возбудителей в слизистой оболочке толстого кишечника с возникновением воспалительных изменений и появлением примеси крови и слизи в испражнениях. Сама по себе она не ведет к развитию нарушений переваривания и всасывания в тонкой кишке, но при воспалении с экссудатом теряется большое количество белка и развивается гипопротеинемия. Моторный компонент диареи присутствует практически при всех случаях синдрома мальабсорбции и обусловлен усилением кишечной перистальтики вследствие растяжения кишки и осмо- и барорецепторов большим объемом содержимого и синтезом гормонально-активных веществ, усиливающих моторику (мотилина, серотонина и др.). В ряде случаев могут наблюдаться ослабление перистальтики и стаз кишечного содержимого, что способствует развитию дисбактериоза и присоединению других механизмов диареи. Такая картина наблюдается, в частности, при воспалительных заболеваниях толстой кишки (язвенном колите, болезни Крона, дивертикулезе толстой кишки). Секреторная диарея возникает, как указывалось ранее, под влиянием бактериальных токсинов. В патогенезе секреторных диарей решающее значение принадлежит нарушению всасывания жидкости в кишечнике вследствие активизации энтеротоксином возбудителей аденилатциклазы в клетках стенки кишечника. Семиотика изменений стула при некоторых заболеваниях у детей. Жидкий, зловонный стул, до 10 раз в сутки, в виде горохового пюре, наблюдается при брюшном тифе, иногда содержит примесь слизи в небольшом количестве. При дизентерии стул необильный, с примесью слизи, прожилок крови, гноя, без запаха, по типу «ректального плевка» на фоне тенезмов. Каловых масс иногда вообще не бывает. Начало заболевания острое, с гипертермией (39—40° С) и схваткообразными болями в животе с их последующей локализацией в области сигмы. Для салъмонеллеза характерно острое начало заболевания с высокой температуры, рвоты, болей в области живота. Стул обильный, водянистый, зловонный, с примесью зелени, по типу «болотной тины». Слизь в небольшом количестве, крови, как правило, не бывает. При холере заболевание начинается с умеренных болей вокруг пупка и частого жидкого стула на фоне нормальной или субфебрильной температуры. Быстро развивается обезвоживание с присоединением в тяжелых случаях рвоты и повышения температуры. Стул обильный, водянистый, без запаха, по типу «рисового отвара» (белесоватая жидкость с хлопьями слизи), никогда не содержит крови. При заболеваниях, вызванных энтеротоксикогенными кишечными палочками, у детей раннего возраста наблюдаются обильные, водянистые, бесцветные испражнения с наличием хлопьев слизи. Может быть острое начало с появлением рвоты и развитием эксикоза. При эшерихиозах, вызванных энтероинвазивными кишечными палочками, наблюдается высокая температура со скудными испражнениями с примесью слизи, крови, болями в животе. Может встречаться в любом возрасте. Заболевания, вызываемые энтеропатогенной кишечной палочкой, наблюдаются у детей в возрасте до 1,5—2 лет и характеризуются постепенным началом с умеренными водянистыми испражнениями, субфебрильной температурой и волнообразным течением. При аденовирусных и энтеровирусных диареях наблюдаются другие клинические признаки этих заболеваний, стул носит калевый характер, 3—5 раз в день, и не развивается обезвоживание организма. При ротавирусных гастроэнтеритах (30—40 % всех больных) наблюдается острое начало заболевания с повышения температуры, рвоты (гастроэнтеритический вариант) и (или) обильного водянистого стула (энтероколитический вариант), иногда с примесью слизи, на фоне скудных респираторных симптомов (умеренная гиперемия, зернистость мягкого нёба и дужек, заложенность носа) с урчанием по ходу толстого кишечника. Заболевание имеет строгую сезонность (октябрь—март). Болеют дети раннего возраста. Стафилококковый энтероколит чаще встречается у детей до года, при наличии характерного эпидемического анамнеза (гнойные очаги у ребенка, неблагоприятный преморбидный фон, мастит у матери, длительное лечение антибиотиками и др.). Наблюдается постепенное развитие кишечной дисфункции на фоне субфебрильной температуры и умеренной интоксикации. Стул жидкий, каловый, с примесью слизи, иногда прожилок крови. Для стафилококковой пищевой токсикоинфекции типично указание на употребление инфицированной пищи (тортов, кремов, пирожных, салатов с майонезом); заболевание чаще всего носит групповой характер. Характерно бурное развитие болезни с упорной, изнуряющей рвотой на фоне высокой температуры и быстрой нормализацией состояния в течение 2—3 сут. Стул жидкий, водянистый, иногда каловый, без патологических примесей. Кампилобактериоз характеризуется острым началом заболевания с болями в области живота, в основном вокруг пупка, предшествующими дисфункциями кишечника, увеличением печени и вовлечением в процесс поджелудочной железы, обильным, «пенистым», зловонным стулом с примесью крови, без признаков дистального колита. Для иерсиниоза характерно наличие полиорганной симптоматики (сыпь на коже, боли в области суставов, увеличение печени и селезенки). При кишечной форме наблюдаются боли в области живота, преимущественно в правой подвздошной области. Стул 3—6 раз в сутки, жидкий, зловонный, каловый, с примесью слизи. При амебиазе стул учащен, в виде «малинового желе» — слизь придает калу стекловидную блестящую поверхность. При лямблиозе стул 3—4 раза в день, желто-зеленого цвета, мягкой консистенции. При массивной инвазии стул учащается до 20 раз в день, становится слизисто-кровавым. При микотических энтероколонопатиях (кандидамикозах) отмечается учащение дефекации, каловые массы обильные, жидкие или пастозные, обычно без большой примеси слизи (кровь, как правило, отсутствует).
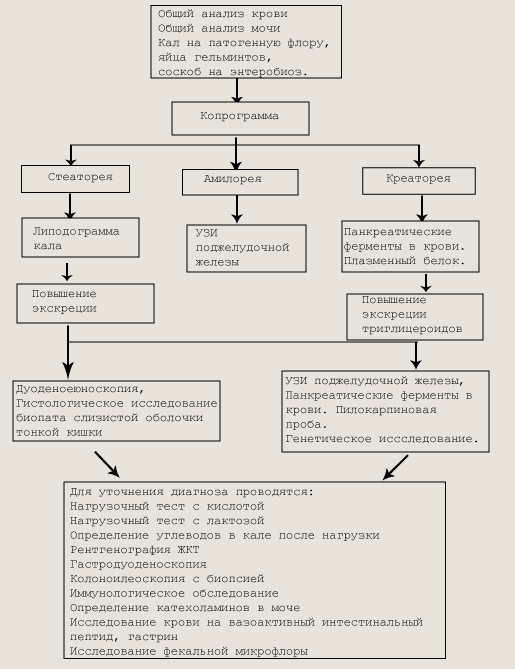
Обследование больного с хронической энтеритической диареей При вирусном гепатите стул ахоличный — серо-глинистого цвета, без патологических примесей. Алгоритм обследования больного с хронической энтеритической диареей представлен на рис. Гастроинтестинальные кровотечения. Кровотечения из желудочно-кишечного тракта у детей раннего и старшего возраста встречаются часто и могут представлять угрозу для жизни. По характеру стула можно определить источник кровотечений. Если он находится в верхних отделах желудочно-кишечного тракта (пищеводе, желудке, двенадцатиперстной и тонкой кишках), то у больного наблюдается мелена (черный гомогенный стул в связи с изменениями гемоглобина крови под влиянием желудочного сока, ферментов и флоры кишечника). Это чаще всего кровотечение при варикозном расширении вен пищевода, язвенной болезни (двенадцатиперстной кишки и желудка, острых язвах медикаментозного генеза), геморрагическом гастрите. В случае кровотечения из терминальных отделов подвздошной кишки и толстого кишечника цвет крови в фекалиях мало изменен. Выделение свежей крови из анального отверстия чаще свидетельствует о локализации источника кровотечения в толстой кишке: полип толстой или прямой кишки (синдромы с полипозом кишечника: Пейтца-Егерса, Гарднера), трещина слизистой оболочки прямой кишки, геморрой, язва меккелева дивертикула, язвенный колит, болезнь Крона, гемангиома кишки. Кровотечения из прямой кишки составляют около 50 % всех желудочно-кишечных кровотечений. При трещинах заднего прохода кровь алого цвета, как правило определяется отдельно от каловых масс. У детей раннего возраста при инвагинации в стуле выявляется примесь кровянистых комочков в виде «малинового желе». Жидкий стул с прожилками крови — признак дизентерии. Дифференциальная диагностика темного стула у новорожденных первых дней жизни затруднена, так как меконий зеленовато-черного цвета. Однако меконий без примеси крови дает зеленое окрашивание пеленок, меконий с примесью крови — красное. В поисках источников скрытой крови в кале у детей прежде всего следует осмотреть полость рта и носа. Темный цвет кала может быть связан с приемом препаратов железа, висмута, гематогена, карболена или определенных продуктов (черники, печени и др.). Диагноз устанавливается на основании данных анамнеза, эзофагогастродуоденоскопии, колоноскопии, сканирования с введением меченных эритроцитов, ангиографии. Причины кровотечений и заболевания, сопровождающиеся кишечным кровотечением у детей, приведены в табл. Скрытую кровь в кале можно обнаружить с помощью бензи-диновой и ортотолуидиновой проб. Положительные пробы бывают при кровотечении из желудочно-кишечного тракта, приеме железосодержащих препаратов, при употреблении в пищу мяса, поэтому за 3 дн до исследования кала на скрытую кровь необходимо исключить из рациона мясную пищу, не чистить зубы.
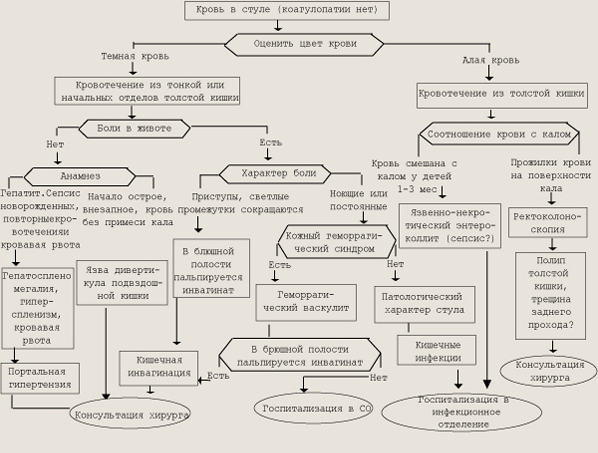
Диагностический поиск при наличии крови в стуле Наиболее частые причины кровотечения из органов пищеварения
Заболевания, сопровождающиеся кишечным кровотечением
СЕМИОТИКА БОЛИ В ЖИВОТЕ. Боль в животе является одной из наиболее частых жалоб у детей. Она может быть сигналом заболевания кишечника, других органов брюшной полости, а также соседних с ней и более отдаленных органов. У маленьких детей эквивалентом боли является беспокойство, крик, отказ от груди. Дети, особенно раннего возраста, редко точно фиксируют место боли в животе, указывая большей частью на область пупка. Дети более старшего возраста, как правило, также неточно указывают на локализацию боли, поэтому это имеет небольшое диагностическое значение. Наиболее частыми причинами болей в животе являются: воспалительные (химические) повреждения тканей или брюшины (аппендицит, колит, панкреатит), гипоксия (например, при ущемленной грыже, инвагинации кишок), растяжение капсулы органа (например, острое увеличение печени), гиперперистальтика (спазм, колика), растяжение стенки кишечника, растяжение его просвета, например скоплением газов (заворот, инвагинация кишок), натяжение корня брыжейки, особенно восприимчивого к болевому раздражению, иррадиирующие боли при заболеваниях, локализующихся вне живота, системные заболевания и др. Наиболее распространенные причины болей, иррадиирующих в живот
Системные заболевания, вызывающие боли в животе
Характер болевых ощущений представляет собой результат суммации сигналов соматической и вегетативной нервной системы. Разный характер болевого синдрома при поражении органов пищеварения объясняется неодинаковой их сенсорной иннервацией. Так, соматическая боль воспринимается и проводится по симпатической нервной системе и ощущается как острая, жгучая или колющая. Исходным пунктом ее является брюшина, поэтому дети старшего возраста хорошо определяют место боли, интенсивность которой увеличивается при изменении положения тела, ходьбе, беге, поднятии руки, характерено также защитное напряжение мышц (defans). Появление острых болей в животе требует исключения хирургической патологии — аппендицита, прободения полого органа, инвагинации кишок, перитонита. Диафрагмальная боль является одновременно и перитонеаль-ной. Болевые импульсы проводятся по диафрагмальному нерву, в связи с этим отмечается иррадиация ее в область плеча, а интенсивность увеличивается при дыхательных движениях и кашле. Пупочная (абдоминальная) колика — схваткообразная повторяющаяся боль — указывает на усиленную перистальтику или перерастяжение некоторых отделов кишечника (скоплением газов, сильным сокращением кишечника перед преградой в его просвете). Эти колики часто встречаются у чувствительных и вегетолабильных детей в возрасте 4—12 лет. Возникают они или во время приема пищи, или после него под влиянием аффекта, большей частью локализуются вокруг пупка, комбинируются с вегетативными симптомами (бледностью, тошнотой, рвотой и др.). Спастические боли встречаются при колитах, энтероколитах, при наличии спаечных процессов. Интенсивные и длительные коликообразные боли в правом подреберье характерны для заболеваний печени и желчных путей. Висцеральная, вегетативная боль исходит из органов, чувствительная иннервация которых обеспечивается парасимпатической и симпатической нервной системой. Боль при этом диффузная, тупая, мучительная, интенсивность ее изменяется и со временем ослабевает, локализуется в глубине брюшной полости. Она сопровождается вегетативными сдвигами в виде рвоты, тошноты, бледности, профузного пота, сердцебиения, общего беспокойства. Разнообразные по характеру боли (тупые, ноющие в одних случаях, острые, мучительные — в других ) встречаются при поражениях поджелудочной железы. «Отраженная» боль представляет собой проявление рефлекторного механизма проведения висцеральной боли по чувствительным цереброспинальным нервам. При этом возникают гиперчувствительность в определенных участках кожи и повышенная болевая чувствительность (зоны Захарьина-Геда). Иррадиация болей в правое плечо, лопатку встречается при заболеваниях печени и желчных путей. Иррадиация в оба подреберья характерна для дуоденитов, панкреатитов, при последних она происходит также в спину, поясницу. Необходимо учитывать локализацию болей в животе, их иррадиацию. Боли в правом верхнем и среднем отделах живота могут быть связаны с поражением печени, желчного пузыря и желчных путей, желудка, двенадцатиперстной кишки, поджелудочной железы, правой почки, правосторонней нижнедолевой пневмонией, аппендицитом (высокое расположение). Боли в левом верхнем и среднем отделах живота характерны для левосторонней нижнедолевой пневмонии, поражения селезенки, поджелудочной железы, сердца, левой почки, желудка. Боли в правой подвздошной области могут указывать на аппендицит, поражение подвздошной кишки, почек, придатков матки, мочевого пузыря. Боли в левой подвздошной области могут быть вызваны поражением толстого кишечника, почки, мочевого пузыря, придатков матки. Важно выявить связь боли с приемом пищи, ее характером (холодная, горячая, острая и т.д.). Боли, возникающие сразу же после приема пищи, характерны для язвы кардиального отдела желудка, боли в сочетании с чувством жжения — для язвы пищевода. Боли, появляющиеся через 2 ч после приема пищи и позже (голодные и ночные), характерны для язвы двенадцатиперстной кишки, боли, появляющиеся через 30 мин после еды, характерны для язвы малой кривизны желудка. Спленомегалия— увеличение селезенки. Многообразие функций селезенки обусловливает разнообразие причин ее увеличения. Селезенка — один из органов защиты при инфекционных заболеваниях, она играет роль депо крови, участвует в кроветворении и обменных процессах. Селезенка у детей увеличивается значительно чаще, чем у взрослых. Спленомегалия может быть первичной (при заболеваниях селезенки) или вторичной (вследствие других заболеваний). Первичная Спленомегалия наблюдается при опухолях (спленоме, гемангиоме), абсцессах, травмах и кисте селезенки. Чаще увеличение селезенки носит вторичный характер, являясь одним из симптомов других болезней. Спленомегалия может быть ведущим симптомом при пяти группах болезней. 1. Острые и хронические инфекционные процессы: вирусные инфекции (инфекционный мононуклеоз, вирусный гепатит, корь, краснуха, орнитозы, цитомегалия, болезнь от кошачьих царапин и др.); бактериальные инфекции (сепсис, брюшной тиф, бактериальный эндокардит, бруцеллез, листериоз, милиарный туберкулез и др.); спирохетозы (врожденный сифилис, болезнь Васильева—Вейля); заболевания, вызванные простейшими (малярия, лейшманиоз, амебиаз, токсоплазмоз); грибковые инфекции (актиномикоз, кокцидиоидомикоз); паразитарные заболевания (эхинококкоз, эозинофильный лейкемоид) и др. Под гиперсп/генизмом понимается неблагоприятное воздействие селезенки на клетки крови. Это анемия с ретикулоцитопенией, лейкопения с гранулоцитопенией, тромбоцитопения или тотальное поражение — панцитопения. Они связаны с увеличением селезенки независимо от характера основного заболевания, повышенным разрушением форменных элементов в селезенке и подавлением их размножения в костном мозге. Термин «синдром мальабсорбции» (плохое всасывание) в практической медицине трактуется широко и используется для обозначения симптомокомплекса, обусловленного нарушением переваривания (мальдигестия) и собственно всасывания (маль-абсорбция) в тонкой кишке одного или нескольких питательных веществ, проявляющегося хронической диареей и приводящего к расстройствам питания и тяжелым метаболическим сдвигам. При этом различаются нарушение переваривания в просвете кишки (полостная мальдигестия), нарушение мембранного пищеварения в щеточной кайме слизистой оболочки тонкого кишечника (мембранная мальдигестия) и нарушение транспорта нутриентов через мембрану энтероцитов вследствие повреждения транспортных систем (собственно мальабсорбция). Комплекс изменений пищеварения и всасывания, по международной терминологии, принято объединять понятием «мальассимиля-ция», поскольку в итоге страдает ассимиляция важнейших нутриентов. Характеристика заболеваний, связанных с нарушением пристеночного переваривания и всасывания углеводов у детей первых лет жизни
СЕМИОТИКА ЗАБОЛЕВАНИЙ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ. Заболевания желчевыделительной системы у всех детей, поступающих в клинику с болями в животе, составляют около 80 %. Соотношение функциональных (дискинезии) и воспалительных (холециститы и холангиты) заболеваний в настоящее время точно не выяснено, так как критерии их лабораторной диагностики достаточно расплывчаты. В то же время анализ симптомов и синдромов поражений печени и желчевыводящих путей позволяет дифференцировать характер поражения этой системы. Среди поражений печени и желчевыводящих путей наиболее часто встречаются нарушения обмена билирубина (желтухи), гепатоспленомегалия, синдромы поражения печени: синдром цитолиза, печеночно-клеточной недостаточности (ге-патопривный), мезенхимально-воспалительный, холестатичес-кий, синдром портокавального шунтирования печени и др. СЕМИОТИКА НАРУШЕНИИ ОБМЕНА БИЛИРУБИНА. Симптомокомплексы гипербилирубинемии — патологические состояния, характеризующиеся нарушением равновесия между образованием и выделением билирубина, основным клиническим признаком которых является желтуха (иктеричность) — желтая пигментация кожи или склер билирубином, обусловленная повышением содержания общего билирубина в сыворотке крови. Хотя точный уровень билирубина в крови, при котором желтуха становится клинически явной, варьирует, ее легко можно обнаружить при уровне билирубина выше 34,2 мкмоль/л (норма 8,5—20,5 мкмоль/л). Желтуха чаще диагностируется при потемнении мочи или желтом окрашивании кожи или склер. Желтая окраска склер объясняется большим количеством в этой ткани эластина, обладающего особым сродством к билирубину, поэтому именно по иктеричности склер часто определяется желтуха. При выраженной желтухе кожа может приобрести зеленоватый оттенок из-за превращения билирубина в биливердин, продукт окисления билирубина. Так как прямой билирубин окисляется быстрее, зеленоватая окраска кожи чаще бывает при желтухе, обусловленной увеличением в крови концентрации прямого билирубина. При воздействии на билирубин синим светом (430—470 нм) образуются полярные метастабильные фотоизомеры билирубина, которые могут экскретироваться в желчь, не будучи связанными, что используется для лечения гиперби-лирубинемии в педиатрии. Желтуху следует отличать от желтой пигментации кожи (ложной желтухи), вызываемой другими причинами, такими как ка-ротинемия (каротиноидные пигменты в крови — при избыточном употреблении пищи, содержащей каротин: тыквы, моркови и красного перца, в особенности при повреждении печени, когда каротин не может быть переработан в витамин А), которая сопровождается желтоватым окрашиванием кожи, но не склер и слизистых оболочек. Желтая окраска возникает также при приеме акрихина и отравлении пикриновой кислотой. В этих случаях тоже говорят о ложной желтухе. Гипербилирубинемия возникает вследствие: 1) повышения продукции пигмента; Первые три вида нарушений связаны в основном с неконъ-югированной гипербилирубинемией. Четвертая группа нарушений (дефект экскреции) ассоциируется прежде всего с конъюги-рованной гипербилирубинемией и билирубинурией. Концентрация неконъюгированного билирубина в плазме крови определяется скоростью поступления в нее вновь синтезированного билирубина (обновление билирубина) и выведения его печенью (печеночный клиренс билирубина), последний показатель связан с нарушением поглощения билирубина печенью или конъюгации либо с тем и другим вместе. Надпеченочная (гемолитическая) желтуха возникает в результате усиленного гемолиза эритроцитов, обусловленного внутри- или внеэритроцитарными факторами: 1) гемолитические анемии (врожденный сфероцитоз, наследственный эллиптоцитоз); Дифференциально-диагностические критерии желтух у детей
Гипербилирубинемия, обусловленная непрямым билирубином, наблюдается также при нарушении транспорта билирубина (без усиленного гемолиза). Процесс поглощения клеткой печени билирубина включает в себя отщепление пигмента от альбумина и последующее связывание его с лигандином. Уменьшение накопления неконъюгированного билирубина в цитозоле из-за снижения активности Y- и Z-протеинов (конкурентное ингибирование, лихорадочное состояние) приводит к накоплению неконъюгированного билирубина в крови. Недостаточный захват билирубина мембраной гепатоцита (интермиттирующая юношеская желтуха Мейленграхта — синдром Жильбера-Лербулле), конкурентное ингибирование (желтуха, обусловленная грудным молоком, — синдром Ариаса, семейная желтуха новорожденных — синдром Люцея-Дрисколла, ингибирование лекарственными средствами — эстрогенами, прегнандиолом, витамином Kj, сульфаниламидами, новобиоцином, рифампицином, флаваспидовой кислотой, некоторыми красителями, используемыми при холецистографии, и др.) приводят к неконъюгированной гипербилирубинемии. У некоторых новорожденных, вскармливаемых грудью, развивается выраженная желтуха — синдром Ариаса — за счет накопления в крови непрямого билирубина, уровень которого прогрессивно повышается до 4-го дня жизни и достигает максимума к 10—15-му дню (до 250—300 мкмоль/л), а затем медленно снижается до нормы к 3—12-й неделе жизни. Гипербилирубинемия выше 12 мг % встречается у 30 % новорожденных, вскармливаемых грудью. Причиной ее возникновения может быть повышенная активность р-глюкуронидазы грудного молока, вызывающая повышение содержания неконъюгированного билирубина в кишечнике с его последующим всасыванием. Высокая концентрация свободных жирных кислот в грудном молоке способна угнетать конъюгацию билирубина. Желтуха в этих случаях может быть обусловлена также тем, что у некоторых женщин в молоке содержатся производные прегнандиола, которые нарушают захват билирубина клетками печени и связывание с глюкуроновой кислотой. Если вскармливание грудью на какой-то период прекратить, то уровень билирубина снижается до нормы в ближайшие 4-8 дн. Основные проявления Функциональных гипербилирубинемий
Транзиторная семейная гипербилирубшемия новорожденных (синдром Люцея-Дрисколла) (аутосомно-рецессивное наследование) отмечается в некоторых семьях, проявляется массивной гипер-билирубинемией, развивающейся у всех детей, рожденных от одной матери, страдающей этим заболеванием, в первые 4 года их жизни. Желтуха при этом более интенсивная, сохраняется дольше, чем физиологическая, и связана с наличием ингибирующих субстанций стероидной природы в плазме и моче матери и новорожденного. Дифференцируют синдром Люцея- Дрисколла с синдромами Криглера-Найяра типов I и II, новобиоциновой желтухой, эстрогеновой (транзиторная желтуха детей, вскармливаемых грудным молоком) и окситоциновой желтухой. Интермиттирующая юношеская желтуха Мейленграхта (синдром Жильбера-Лербулле) — хроническая семейная неконъюгированная гипербилирубинемия, чаще возникающая в пубертатном периоде и имеющая доброкачественное течение. Билирубинемия выражена в умеренной степени (уровень билирубина в пределах 17—85 мкмоль/л) и не сопровождается нарушением биохимических показателей функции печени и ее гистологической картины. В популяции частота синдрома Жильбера составляет 2—5 %. При синдроме Жильбера снижается связывание билирубина с глюкуроновой кислотой в печени до 30 % от нормального. В желчи увеличивается содержание преимущественно мо-ноглюкуронида билирубина и в меньшей степени — диглюкуронида. Заболевание наследуется по аутосомно-рецессивному типу. В основе заболевания лежит генетический дефект — наличие на промоторном участке А(ТА)6ТАА гена, кодирующего УДФГТ 11, дополнительного динуклеотида ТА, что приводит к образованию участка А(ТА)7ТАА. Удлинение промоторной последовательности нарушает связывание фактора транскрипции IID, что приводит к уменьшению образования фермента УДФГТ 1. Однако только снижение синтеза ферментов не приводит к развитию синдрома Жильбера, это происходит при наличии других факторов: скрытого гемолиза и нарушения транспорта билирубина в печени. Это может быть обусловлено дефектом связывания билирубина печенью — дефектами лигандинов, нарушением потребления билирубина печенью и в некоторой степени уменьшением глюкоронилсвязывающего пространства (вследствие генетически детерминированного нарушения структуры мембраны васкулярного полюса гепатоцитов (это ведет к изменению проницаемости мембраны), отщепления в ней свободного билирубина от связи с альбумином и переноса билирубина в гепатоцит). При этом уже вторично не происходит конъюгации билирубина, и возникает непрямая гипербилирубинемия. Поэтому при синдроме Жильбера отмечается также небольшое нарушение выделения бромсульфалеина и толбутамида (препараты, которые не подвергаются конъюгации). Заболевание может сочетаться с семейным повышением активности щелочной фосфатазы кишечного происхождения. При синдроме Жильбера наследственная недостаточность УДФГТ предрасполагает к проявлению токсического действия парацетамола, особенно при приеме его в больших дозах, так как он не связывается с глюкуроновой кислотой, а катаболизируется в системе цитохрома Р450 с образованием токсического метаболита. В клетках периферической крови выявляются нарушения, напоминающие смешанную порфирию, вероятно вследствие увеличения концентрации билирубина в клетках печени. В моче и кале снижается содержание стеркобилина из-за нарушения образования конъюгированного билирубина в гепатоцитах и, следовательно, их производных в желчных канальцах и кишечнике. Заболевание сопровождается вегетативной лабильностью, нарушением пищеварения, снижением трудоспособности. Прогноз заболевания благоприятный. Эпизоды желтухи при нем возникают в течение всей жизни, она может усиливаться после интеркуррентных инфекций или после голодания, иногда сопровождается слабостью, тошнотой и часто неприятными ощущениями в области печени. Специальные диагностические пробы при синдроме Жильбера включают пробу с голоданием (повышение уровня билирубина в сыворотке на фоне голодания), пробу с фенобарбиталом (прием фенобарбитала, индуцирующего коньюгирующие ферменты печени, вызывает снижение уровня билирубина), пробу с никотиновой кислотой (внутривенное введение никотиновой кислоты, которая уменьшает осмотическую резистентность эритроцитов, вызывает повышение уровня билирубина). При биопсии печени выявляется снижение содержания конъюгирующих ферментов. В отдельных случаях в период новорожденности создаются условия для подавления глюкуронизации временно медикаментами, что приводит к появлению желтухи или ее усилению. При подозрении на такие случаи необходимо тщательно расспросить родственников. Гипербилирубинемш, связанная с нарушением конъюгации билирубина (снижение активности билирубинглюкоронилтрансфера-зы). Почти у каждого новорожденного на 2—5-й день жизни определяется незначительная преходящая неконъюгированная билирубинемия (не выше 150 мг/л) — «физиологическая» желтуха. Она обусловлена возрастной незрелостью глюкоронил-трансферазной системы и исчезает обычно к 7—10-му дню. Степень желтушности у недоношенных детей обычно более значительна, держится дольше (до 4 нед). Повышение концентрации билирубина может достигать более 200 мкмоль/л, что создает опасность поражения мозга (билирубиновая энцефалопатия). Длительная и значительно выраженная желтуха (до 2—4 мес) наблюдается при врожденном гипотиреозе. Удевочек гипотиреоз встречается в 3 раза чаще, чем у мальчиков. Гипотиреоз препятствует нормальному созреванию глюкоронилтрансферазы. Уровень билирубина повышается до 220—340 мкмоль/л, желчные пигменты в моче не определяются, стул всегда окрашен. Подтверждением диагноза служит снижение уровня тироксина и трийодтиронина в сыворотке крови при высоком уровне тиреотропного гормона и эффективности соответствующего лечения. Могут встречаться также как врожденные, так и приобретенные нарушения связывания билирубина, обусловленные нарушением активности глюкоронилтрансферазы (синдром Криглера—Найяра, ингибирование глюкуронизации лекарственными средствами). При синдроме Криглера—Яаияра известны две формы заболевания: I типа — клинически тяжелая, обусловленная отсутствием глюкоронилтрансферазы, и II типа — связанная с частичным ее дефицитом. Наследуется по аутосомно-рецессивному типу. Дефект при синдроме Криглера—Найяра I типа локализуется в одном из пяти экзонов (1А-5) гена УДФГТ 1*1, что приводит к преждевременному появлению стоп-кодонов и синтезу дефектных неактивных форм УДФГТ. При I типе уровень неконъюгированного билирубина достигает высоких цифр (более 250—340 мкмоль/л), что нередко вызывает ядерную желтуху (дети чаще погибают в течение первого года жизни на фоне ядерной желтухи). При фототерапии уровень билирубина в сыворотке крови удается снизить почти на 50 %, этот метод можно применять и амбулаторно. В течение первого и второго десятилетия жизни в любой момент может развиться энцефалопатия (ядерная желтуха). При II типе синдрома Криглера-Найяра также выявлены мутации в экзонах 1А-5, но при изучении экспрессии этих мутантных генов выявлена остаточная активность фермента (определяется частичный дефицит глюкоронилтрансферазы), с этим связаны менее высокая, чем при I типе, билирубинемия, наличие глюкуронидов в моче и эффективность лечения фенобарбиталом. У больных II типом уровень билирубина в крови ниже (между 80—200 мкмоль/л). Назначение фенобарбитала в дозе 5 мг/кг/сут при II типе вызывает существенное уменьшение билирубинемии (до 50 мкмоль/л в течение 2 нед), при I типе билирубин под влиянием фенобарбитала не снижается. Дифференцировать I и II типы синдрома Криглера-Найяра можно, оценив эффективность лечения фенобарбиталом путем определения фракций билирубина с помощью жидкостной хроматографии. При II типе уровень билирубина в сыворотке и доля неконъюгиро-ванного билирубина снижаются, а содержание моно- и диконъюгатов в желчи увеличивается. При I типе уровень билирубина в сыворотке крови не снижается, а в желчи выявляется преимущественно неконъюгированный билирубин. Приобретенные нарушения активности глюкоронилтрансферазы могут быть вызваны действием лекарственных средств (например, угнетение фермента) или заболеванием печени. Однако при повреждении клеток печени экскреторная способность печени нарушается в большей степени, чем ее способность к связыванию билирубина глюкуроновой кислотой. Поэтому при большинстве гепатоцеллюлярных заболеваний гипербилирубинемия связана в основном с конъюгированным билирубином. Гипербшшрубинемия на фоне преобладания в крови прямого билирубина. Нарушение экскреции билирубина в желчные протоки, независимо от того, обусловлено оно механическими или функциональными факторами, приводит к преимущественному развитию гипербилирубинемии и билирубинурии, связанной с повышением уровня прямого билирубина. Билирубин в моче является важнейшим признаком гипербилирубинемии, связанной с прямым билирубином. Желтуху, обусловленную гепатоцеллюлярным заболеванием, редко можно дифференцировать от желтухи, вызванной обструкцией внепеченочных желчных протоков, только на основании изменений в обмене билирубина. Наследственная конъюгированная гипербилирубинемия (синдромы Дубина-Джонсона, Ротора) проявляется умеренно выраженной желтухой, наследуемой по аутосомно-рецессивному типу. При ней нарушается транспорт билирубина и других органических анионов из печени в желчь. Обычные функциональные пробы не отличаются от нормы. Заболевание проявляется с 2-летнего возраста. Синдром Дубина-Джонеона — семейная хроническая доброкачественная желтуха, наследуемая по аутосомно-рецессивному типу, характеризующаяся появлением темного пигмента в центрилобулярной области гепатоцитов («шоколадная печень»). Функционально при этом отмечается дефект билиарной экскреции билирубина, темного пигмента и порфиринов. В основе развития синдрома лежит ухудшение транспорта в желчь многих органических анионов, не относящихся к желчным кислотам, которое обусловлено дефектом АТФ-зависимой транспортной системы канальцев. В крови больных содержится 30—150 мг/л в основном конъюгированного билирубина, причем больше диконъюгированного, чем моноконъюгированного. У больных нарушена экскреция копропорфирина — экскретируется преимущественно копропорфирин I (в норме в моче содержится копропорфирин III и небольшое количество копропорфирина I). При данном синдроме нарушается экскреция многих метаболитов, в том числе конъюгированного билирубина, его свободной фракции и йодированных красителей, но экскреция желчных кислот остается в норме. Классическим признаком этого синдрома является неудача попыток пероральной или внутривенной холецистографми. При лапароскопии определяется необычный насыщенный черный цвет печени с участками, окрашенными в синий и аспидный цвет. В биоптате в печеночных клетках выявляется накопление коричнево-черного пигмента в виде больших аморфных гранул, связанных с лизосомами. Пигмент образуется в результате нарушения секреции анионных метаболитов тирозина, фенилаланина и триптофана. При заболевании вирусным гепатитом у таких больных происходит временная мобилизация этого пигмента. Синдром Дубина-Джонсона не сопровождается зудом, активность щелочной фосфатазы и уровень желчных кислот в сыворотке крови сохраняются в пределах нормальных значений. Экскреция органических анионов в желчь нарушается, их поглощение печенью не страдает. Содержание копропорфиринов в моче нормальное, но доля изомера типа I увеличивается. Диагностическое значение имеет задержка бром-сульфалеина, при этом после начального снижения концентрации красителя в сыворотке крови происходит повторное ее повышение, так что через 120 мин она превышает концентрацию на 45-й минуте. В основном прогноз при этом заболевании благоприятный. Контрастное вещество, введенное при внутривенной холангиографии, не концентрируется, но при сцинтиграфии экскреция лидофенина (меченное 99тТс производное иминодацетата) свидетельствует об отсутствии изменений печени, желчных протоков и желчного пузыря. Синдром Ротора (С Р)— идиопатическая семейная доброкачественная гипербилирубинемия с адекватным повышением конъюгированного и неконъюгированного билирубина. Синдром Ротора сходен с синдромом Дубина-Джонсона, однако коричневый пигмент в гепатоцитах отсутствует, и конъю-гированный билирубин крови состоит в большей степени из моноконъюгатов, чем диглюкуроновых конъюгатов. Патогенез заключается в нарушенном захвате неконъюгированного билирубина гепатоцитами, изменении его глюкоронирования и выведении с последующим рефлкжсом билирубина в кровь. Клинически СР проявляется хронической желтухой или субиктерич-ностью кожи и слизистых оболочек. Увеличения печени и селезенки не наблюдается. При электронной микроскопии могут выявляться патологические изменения митохондрий и перокси-сом. В моче повышен общий уровень копропорфиринов, но не увеличена доля копропорфирина I. Желчный пузырь при холецистографии визуализируется, а при бромсульфалеиновой пробе вторичного повышения концентрации красителя не происходит. Причиной задержки бромсульфалеина при этом оказывается, скорее, не нарушение экскреции, свойственное синдрому Дубина-Джонсона, а нарушение поглощения препарата печенью. При исследовании лидофенином печень, желчный пузырь и желчные протоки не визуализируются. Прогноз благоприятный. Приобретенные нарушения активности глкжоронилтрансфе-разы билирубина могут быть вызваны действием лекарственных средств (например, угнетение фермента левомицетином, пре-гнандиолом и др.) или заболеванием печени (гепатит, цирроз и др.). При гепатоцеллюлярном заболевании (гепатит, цирроз) нарушаются три основных этапа обмена билирубина — его поглощение печенью, связывание и экскреция. Причем экскреция представляет собой этап, ограничивающий скорость обмена билирубина, и обычно именно он нарушается в большей степени. В результате при этих заболеваниях преобладает гипербилируби-немия, обусловленная главным образом прямым билирубином. Паренхиматозная желтуха чаще возникает при остром вирусном и токсическом гепатитах, хроническом гепатите, циррозе печени (билиарный цирроз при холестазе, стенозе желчных путей, при недостатке альфа-1-антитрипсина, муковисцидозе, болезни Вильсона-Коновалова, при галактоземии и непереносимости фруктозы), реже — при вторичных гепатитах, развивающихся при различных инфекционных заболеваниях (инфекционном мононуклеозе, инфекции Коксаки, лептоспирозе), бактериальных заболеваниях (сепсисе, тифе, бруцеллезе и др.). При повреждении печеночных клеток возникает сообщение между желчными путями, кровеносными и лимфатическими сосудами, через которое желчь поступает в кровь и частично в желчевыводящие пути. Отек перипортального пространства также может способствовать обратному всасыванию желчи из желчных ходов в кровь. Набухшие печеночные клетки сдавливают желчные протоки, создавая механическое затруднение оттоку желчи. Нарушаются метаболизм и функции печеночных клеток. Билирубинемия обусловлена преимущественно конъюгированным билирубином. В то же время в крови повышается уровень свободного билирубина, что связано со снижением таких функций гепатоцита, как захват, внутриклеточный транспорт свободного билирубина и его связывание в глюкурониды. Попадание в кровь вместе с желчью желчных кислот обусловливает развитие холемического синдрома. Уменьшение поступления желчи в кишечник (гипохолия, ахолия) ведет к понижению образования метаболитов билирубина и их выделения с мочой и калом (следы стеркобилина), а также появлению симптомов ахоличес-кого синдрома. Насыщенный желтый цвет мочи обусловлен повышенным содержанием в ней конъюгированного билирубина (билирубинурия) и уробилина, который недостаточно разрушается в печени после поступления в нее благодаря печеночно-кишечному кругообороту, попадает в общий кровоток и выводится почками (уробилинурия). Желтушность обычно имеет лимонный или красноватый оттенок. Печень увеличена. Функциональные пробы печени патологические, повышена активность печеночных ферментов. Желтуха наблюдается при нарушении оттока желчи (обтурационная или механическая) из-за атрезии желчных путей, обту-рации их камнем, сдавления желчных путей опухолевым процессом, увеличенными лимфатическими узлами или сгущением желчи. Механическое препятствие оттоку желчи приводит к застою (внепеченочный вторичный холестаз) и повышению давления желчи выше 2,7 кПа (270 мм вод. ст.), расширению и разрыву желчных капилляров и поступлению желчи прямо в кровь или через лимфатические пути. Желтуха нарастает постепенно (за счет конъюгированного билирубина), иногда она бывает перемежающейся. В крови увеличивается содержание холестерина, желчных кислот, щелочной фосфатазы. Стул ахоличный (или частично), так как при ахолии не образуется стеркобилин, который исчезает и из мочи, выявляются билирубинурия (темная окраска мочи — цвета пива) и наличие желчных кислот в моче. Желтушность кожных покровов имеет зеленоватый или серо-зеленоватый оттенок. Обычно наблюдается кожный зуд. Холемичес-кий синдром характеризуется брадикардией и снижением артериального давления, токсическое действие желчных кислот на центральную нервную систему проявляется в виде повышенной утомляемости, нарушения сна, головной боли и др. При этом наблюдается расстройство кишечного пищеварения, что проявляется стеатореей, нарушением всасывания жирорастворимых витаминов (ретинола, токоферола, филлохинона) и развитием авитаминозов. Дефицит витамина Е приводит к прогрессирующей мозжечково-спинальной дегенерации (синдром Пермуттера). Отсутствие желчных кислот приводит к нарушению моторики кишечника, усилению гнилостных и бродильных процессов в кишечнике из-за снижения бактерицидных свойств желчи. Чаще всего встречается у новорожденных атрези я желчных путей. Характерны медленное нарастание уровня конъюгированного и неконъюгированного билирубина и постепенное обесцвечивание стула, увеличенная, плотная печень, быстрое повышение уровня щелочной фосфатазы, в то время как альфа-фетопротеин (в противоположность гепатитам новорожденных) не определяется (реакция Оухтерлони). Типичны повышение концентрации холестерина в крови и нормальный или сниженный уровень сывороточного железа (в противоположность паренхиматозной желтухе). Семейный доброкачественный возвратный холе с та з — синдром Аагенееа-Саммерскилла- Тигструппа (холестаз норвежский) — холестаз с лимфедемами. В патогенезе его имеет значение гипоплазия лимфатических сосудов печени и других органов. Клинически заболевание проявляется признаками холестаза уже в неонатальном периоде. Затем холестаз самостоятельно уменьшается, рецидивирует у взрослых. Типичны гепатомегалия и нарушение функций печени, дефицит жирорастворимых витаминов. Медленно развиваются лимфатические отеки. Дифференциальный диагноз синдрома Аагенеса проводится со всеми синдромами холестаза и врожденных лимфатических отеков (синдромы Вевера-Смита, Милроя). Злокачественный семейный холестаз (болезнь Бойлера + синдром Клеитон-Юберга) проявляется на первом году жизни желтухой, которая самостоятельно разрешается через несколько недель или месяцев. Затем интенсивность желтухи нарастает, присоединяется сильный зуд. Печень и селезенка существенно увеличиваются. Присоединяется геморрагический синдром из-за поражения паренхимы печени. Эхографически печень выглядит плотной (напоминает цир-ротическую), в просвете желчного пузыря наблюдается густой застой. Прогноз заболевания неблагоприятный. Холестатический синдром может наблюдаться у детей при холангиохолитах, когда к признакам нарушения оттока желчи присоединяются симптомы бактериальной инфекции (лихорадка, лейкоцитоз, сдвиг лейкоцитарной формулы, повышенная СОЭ). У детей раннего возраста холангиохолит может быть осложнением тяжелых энтеритов, оперативных вмешательств на кишечнике, механических препятствий оттоку желчи (камни, стриктуры, глистная инвазия и др.). При внутриклеточном холестазе (синдромы Ротора, Дубина-Джонсона, острая алкогольная дистрофия печени, циррозы, тяжелые формы общих инфекционных заболеваний) в отличие от внепеченочного отсутствуют боли в области печени; холангит, расширение желчных ходов, увеличение органа незначительные. Капиллярный и прекапиллярный холес- таз свойствен болезни Ходжкина, дуктулярный холестаз — синдрому Алажиль, злокачественному рецидивирующему холестазу, желтухе наркоманов. Дуктулярный, интралобулярный холестаз с вовлечением в процесс септальных желчных ходов типичен для синдрома Кароли, атрезии внутрипеченочных желчных ходов и первичного билиарного цирроза. Септальные внутрипе-ченочные желчные ходы и ходы большого диаметра поражаются при склерозирующем холангите, холангиокарциноме. Следует иметь в виду, что внепеченочный холестаз может развиться при пневмонии, лептоспирозах, сальмонеллезах, коли-инфекции мочевыводящих путей, при этом имеет место сочетание хо-лестаза с выраженной токсической зернистостью нейтрофилов. При лекарственной холестатической желтухе характерны зуд, эозинофилия и биохимические признаки холестаза, гистологически печень необильно инфильтрирована эозинофилами и мононуклеарами. Диагностический алгоритм при желтухах. При выявлении клинико-лабораторных признаков желтухи необходимо решить три основные задачи: 1) определить тип гипер-билирубинемии — конъюгированная или неконъюгированная; В решении этих задач помогают: данные анамнеза — наследственная отягощенность, гемотрансфузии, контакт с инфекционными больными, гепатотропными ядами, прием лекарств, зуд кожи, боли в животе и др.; объективное обследование — позволяет в большинстве случаев разграничить эти желтухи. Во всех случаях холестаз (за исключением внутриклеточного) характеризуется зудом, повышением содержания в крови прямого билирубина, холестерина, щелочной фосфатазы. Активность ферментов сыворотки крови может указывать на нарушение целостности цитоплазматической мембраны гепато-цитов (повышение активности АсАТ, АлАТ, фруктозомоно- и фруктозобифосфат-альдолазы и др.) и их митохондрий (повышение активности глутаматдегидрогеназы, урокиназы) или повреждение лизосом (рибонуклеазы, лейцинаминопептидазы, катепсинов), а также свидетельствовать о дефекте секреторной (понижение активности холинэстеразы) или экскреторной (повышение активности щелочной фосфатазы) функции печени. Степень повышения активности митохондриальных и лизосо-мальных энзимов коррелирует с тяжестью поражения печени. При анализе результатов лабораторного, исследования необходимо иметь в виду, что для обтурационной желтухи характерно увеличение содержания щелочной фосфатазы более чем в 3 раза, а гипертрансфераземия не превышает норму более чем в 5 раз. Диагностика вирусного гепатита в значительной мере основывается на результатах серологических исследований и обнаружении маркеров гепатитов А, В, С, D, Е и др. в специализированных лабораториях. Серологическими маркерами вирусов гепатита являются: HAV - HAV Ab IgG, HAV AB IgM, HAV РНК; HBV - HBsAg, HBsAb, HBeAg, HBeAb, HBcAb IgM, HBcAb IgG, HBV ДНК; HCV - HCV Ab IgG, HCV IgM, HCV РНК; HDV - HDV Ab IgG, HDV Ab IgM, HDV РНК; HEV - HEV Ab IgG, HEV Ab IgM, HEV РНК. Кроме вирусных гепатитов А, В, С, D, Е возможны гепатиты, вызванные цитомегаловирусами, вирусами герпеса, Кулихорадки и желтой лихорадки, Коксаки, кори, Эпстайна—Барра. Иногда желтуха наблюдается при обострении хронического гепатита. При желтухах с синдромом холестаза состояние желчевыво-дящих путей уточняется при ультрасонографии. Наряду с оценкой состояния внутри- и внепеченочных желчных протоков можно диагностировать диффузную патологию и очаговые дефекты в печени (абсцесс, киста, опухоль), холелитиаз, асцит (не менее 100 мл), расширение портальной вены, патологию поджелудочной железы и др. Однако при ранней или частичной обструкции общего желчного протока у части больных расширение его отсутствует, что не позволяет установить причину желтухи. Исследование затруднено при циррозе печени, склерозирующем холангите, асците, ожирении и метеоризме. Компьютерная томография информативна для диагностики холестаза и более информативна в оценке состояния паренхимы печени, а также при наличии асцита, метеоризма, чем уль-трасонография. Чрескожная пункционная биопсия печени позволяет диагностировать острые и хронические гепатиты, гепатозы, циррозы печени, первичную или метастатическую опухоль. Еще большую диагностическую ценность биопсия имеет при использовании лапароскопии с помощью волокнистой оптики, при которой дополнительно визуально оценивается состояние желчного пузыря, печени и печеночной капсулы, селезенки, брыжейки и др. При необходимости используются внутривенная холангиография, транспеченочная холангиография, радионуклидная динамическая гепатохолецистосцинтиграфия. СИНДРОМЫ ПОРАЖЕНИЯ ПЕЧЕНИ. Болезни печени сопровождаются рядом клинических синдромов, знание которых имеет важное значение для своевременной диагностики и адекватной терапии заболеваний печени. Чаще встречаются следующие симптомокомплексы: воспаления печеночной ткани, нарушения портального кровообращения, обусловленного поражением печени, симптомокомплекс острой и хронической печеночной недостаточности и др. Симптомокомплекс воспаления печеночной ткани представляет собой сочетание морфологических, физиологических и метаболических изменений, возникающих в организме в ответ на действие различных повреждающих печень факторов: биологических (вирусов, бактерий, грибов, иммунных комплексов и др.), токсических, физических и др. Он включает ряд синдромов: ци-толитический, мезенхимально-воспалительный, холестатический, гепатопривный. Цитолитический синдром возникает вследствие нарушений структуры клеток печени. Эти нарушения иногда ограничиваются только клеточными мембранами, но чаще распространяются на цитоплазму и охватывают отдельные клетки в целом. Цитолиз — один из основных показателей активности патологического процесса в печени. Цитолитический синдром характеризуется повышением в плазме крови уровня АсАТ, АлАТ, ГЛДГ, 5-й фракции лактатдегидрогеназы (ЛДГ5), а также фер-ритина, сывороточного железа. Соотношение АсАТ/АлАТ (коэффициент Де РитисаЗ отражает степень тяжести поражения печени (в норме 1,3—1,4). Повышение коэффициента Де Ритиса более 1,4 (преимущественно за счет АсАТ) наблюдается при тяжелых поражениях печени с разрушением большей части печеночной клетки (хронический активный гепатит с высокой степенью активности, цирроз печени, опухоль). При острых процессах, разрушающих мембрану клетки и не затрагивающих глубинные структуры печеночной клетки, коэффициент Де Ритиса меньше 1,2. Морфологически для этого синдрома характерны ацидофильная и гидропическая дистрофия, некроз гепатоцитов с повреждением клеточных мембран и повышением их проницаемости. Синдром печено чно-клеточно и недостаточности характеризуется лихорадкой, снижением массы тела, желтухой, геморрагическим диатезом, внепеченочными знаками: «печеночный язык», «печеночные ладони», «сосудистые звездочки», изменение ногтей, оволосения, гинекомастия и др. В крови наблюдаются снижение уровня альбуминов, холестерина, концентрации компонентов свертывающей и антисвертыва-ющей системы крови (протромбин, факторы V, VII, фибриноген и др.), повышение уровня билирубина, трансаминаз (АсАТ, АлАТ), печеночно-специфических ферментов (фруктозо-1-фос-фатальдолазы, сорбитдегидрогеназы, орнитинкарбамилтранс-феразы и др.), признаки нарушения других функций печени. Показано, что при легких острых и хронических заболеваниях печени выраженных изменений уровня холестерина нет. В то же время при среднетяжелых и особенно тяжелых поражениях печени наблюдается отчетливое снижение уровня холестерина, что является тревожным сигналом, свидетельствующим о возможности развития печеночно-клеточной недостаточности. Морфологически для этого синдрома характерны дистрофические изменения гепатоцитов, значительное уменьшение функциональной паренхимы печени вследствие изменений последней. Мезенхимальн о-в оспалительный синдром свидетельствует об активности патологического процесса в печени. Клинически характеризуется лихорадкой, артралгиями, лимфаденопатией, спленомегалией, васкулитами (кожа, легкие). К индикаторам этого синдрома следует отнести уровень гамма-глобулинов сыворотки крови, концентрации сывороточных иммуноглобулинов IgA, IgM, IgG, повышение показателей осадочных проб (повышение показателей тимоловой пробы), увеличение СОЭ, появление в крови продуктов деградации соединительной ткани (серомукоид, гексозы, С-реактивный белок и др.). Повышение концентрации IgM характерно для первичного билиарного цирроза, IgG — для активного хронического гепатита, IgA — для алкогольного поражения печени. Для мезенхимально-воспалительного синдрома характерны также изменения в клеточных и гуморальных иммунных реакциях: появление LE-клеток, антител к субклеточным фракциям гепатоцита (ДНК, печеночному липопротеиду), антимитохонд-риальных и антиядерных антител, антител к гладкой мускулатуре, изменение количества и функциональной активности Т- и В-лимфоцитов и их субпопуляций. Морфологически данный синдром характеризуется активацией и пролиферацией лимфоидных и ретикулогистиоцитарных клеток, внутрипеченочной миграцией лейкоцитов, усилением фиброгенеза, формированием активных септ с некрозами вокруг них, васкулитами. Холестатический синдром характеризуется либо первичным (дисрегуляция собственно желчьсекретирующих механизмов гепатоцитов), либо вторичным нарушением секреции желчи. Вторичное нарушение секреции желчи развивается в случаях желчной гипертензии, которая в свою очередь связана с препятствием нормальному току желчи в желчевыводящих путях. Клинические проявления: упорный кожный зуд, желтуха, пигментация кожи, ксантелазмы, потемнение мочи, посветление кала. К индикаторам холестаза относятся следующие тесты сыворотки крови: повышение уровня конъюгированного билирубина, желчных кислот (дезоксихолевой и холевой), холестерина, р-липопротеидов, щелочной фосфатазы, гаммаглутаматгранс-пептидазы и др. При холестазе в моче появляются желчные пигменты (билирубин), стеркобилин снижается или исчезает в кале. При внутрипеченочном холестазе выявляется накопление желчи в желчных ходах, а при внепеченочном — расширение междольковых желчных протоков, изменение их эпителия с накоплением в дальнейшем компонентов желчи в гепатоцитах и во всей билиарной системе. Внутриклеточный холестаз проявляется ультраструктурными изменениями гепатоцита и гиперплазией гладкой цитоплаз-матической сети, изменением билиарного полюса гепатоцита, накоплением компонентов желчи в гепатоците. Синдром портокава/гьного шунтирования печени, синдром «отключенной» печени. Индикаторы шунтирования печени — вещества, которые в норме поступают главным образом из кишечника в систему воротной вены и печень. В патологических условиях, минуя печень (при развитии венозных коллатералей), эти вещества поступают в систему общего кровотока. Концентрация этих веществ, следовательно, в сыворотке крови резко повышается при портокавальном шунтировании, что свидетельствует в пользу синдрома «отключенной» печени. Тесты этого синдрома следующие: аммиак сыворотки крови (в норме 28,6—85,8 мкмоль/л), общие фенолы сыворотки крови (в норме 5—8 мг/л), жирные кислоты с короткой цепью (в норме 8,7 + 3,9 мг %), аминокислоты: тирозин (в норме 44—72 мкмоль/л), фенилаланин (в норме 37—88 мкмоль/л), триптофан (в норме 25—73 мкмоль/л), метирнин (в норме 6—40 мкмоль/л). Острая печеночная недостаточность. Определяется как острое и прогрессирующее ухудшение функции печени, развивается у детей преимущественно при злокачественных формах вирусного гепатита В, С, D или других диффузных поражениях печени, острых отравлениях, как осложнение предшествующих врожденных заболеваний, анатомических или метаболических нарушений. У детей раннего возраста она чаще развивается при вирусном гепатите (В, С, D), отравлениях гепатотропными ядами (грибами — бледной поганкой, строчками, мухоморами и др.). Острая печеночная недостаточность развивается при 75—80 % поражении паренхимы. Выделяются 4 вида острой печеночной недостаточности: 1) острая гепатоцеллюлярная недостаточность, в основе которой лежит нарушение функции гепатоцита; На развитие клинического синдрома острой печеночной недостаточности указывает атипичное течение гепатита: стойкая потеря аппетита, нарастающая желтуха, падение протромбино-вого индекса, снижение уровней альбумина и фибриногена в сыворотке, изменения поведения ребенка в виде адинамии, апатии, сонливости, реже — возбуждения, беспокойства. Изо рта, от пота и мочи ощущается сладковатый запах —«печеночный». Размеры печени начинают уменьшаться. Энцефалопатия может развиться через несколько дней после начала заболевания. Этиологическим фактором возникновения печеночной энцефалопатии и комы являются ряд токсинов — аммиак, меркаптаны, жирные и ароматические кислоты. Выделяются 4 стадии печеночной комы: 1-я — изменение эмоциональной реакции (эйфория); Острая печеночная недостаточность также характеризуется подъемом уровня аминотрансфераз (АсАТ и АлАТ) в 100 и более раз по сравнению с исходным. Уровень протромбина падает в 3 раза, фракции как прямого, так и непрямого билирубина повышаются, а уровень альбумина сыворотки понижается. Содержание азота в крови может понижаться, если печень не способна синтезировать мочевину. У больных, находящихся в коматозном состоянии, отмечается повышение уровня аммиака в сыворотке крови. При биопсии печени выявляется некроз гепа-тоцитов без признаков регенерации. Хроническая печеночная недостаточность развивается постепенно и является чаще терминальным исходом хронических заболеваний печени (хронический гепатит В, D, С и др.). Гепатомегалия. Печень у новорожденных и детей первого года жизни выступает из подреберья на 1—2 см. Физиологической нормой считается расположение печени на 1 см ниже реберной дуги у детей дошкольного возраста. Гепатомегалия — увеличение печени — наиболее частый симптом болезней печени. Как проявление висцероптоза у лиц астенического телосложения, при ряде заболеваний (в том числе при рахите, миопатиях и др.) край печени может выступать на 1—3 см книзу от реберной дуги у детей различного возраста. В связи с этим для уточнения генеза такого «увеличения» необходимо определять размеры печени по Курлову. Патологическое увеличение печени может быть обусловлено различными причинами. Размеры печени по Курлову в зависимости от возраста
Наиболее частые причины гепатомегалии у детей
Диагностика гепатомегалии у детей
Увеличение печени инфекционного происхождения может быть при острых и хронических диффузных заболеваниях печени (вирусном гепатите А, В, С, D ), инфекционном мононуклео-зе, сепсисе, дифтерии, скарлатине, генерализованном туберкулезе, при брюшном, сыпном, возвратном тифе, бруцеллезе, врожденном сифилисе, малярии, паразитарных заболеваниях (эхинококкозе, лямблиозе, амебиазе, токсоплазмозе). Заболевания сердца и легких (миокардит, врожденные пороки сердца, пневмонии и др.) у детей в результате развития правожелудоч-ковой недостаточности ведут к значительному увеличению печени («сердечная печень»). Необходимо иметь в виду препятствия току крови при констриктивном перикардите и тромбозе печеночных вен (синдром Бадда-Киари). Гепатомегалия — постоянный симптом при болезнях крови (лейкозе, неходжкинских лимфомах, лимфогранулематозе, гистиоцитозе X, гемолитических анемиях, синдроме Якша-Гайема), при первичных ее опухолях (злокачественной гепатоме — гепатоцеллюлярном раке с высоким содержанием альфа-фетопротеина в крови, кавернозной гемангиоме, саркоме, кисте печени, эхинококковых кистах) или метастазах опухолей (нейробластома, лимфогранулематоз и лейкоз, аденокарциномы и др.) Причиной гепатомегалии могут быть болезни накопления: липидозы (синдромы Сайпа-Лоуренса, Биглера-Хсиа, Фарбера, болезнь острова Танжье), церебрози-дозы (болезни Ниманна-Пика, Гоше), гликогенозы (болезни Гирке, Помпе и др.), болезни обмена веществ (тирозиноз, гомоцистинурия, галактоземия, мукополисахаридозы, болезнь Вильсона-Коновалова, недостаточность альфа-1-антитрипсина, гемохроматоз, амилоидоз, непереносимость фруктозы и др.). Хронические нарушения питания (дефицит белков при обильном употреблении жиров и углеводов), квашиоркор, сахарный диабет, синдром Мориака сопровождаются увеличением печени. Увеличение печени могут симулировать поддиафрагмальный абсцесс, эмфизема легких (низкое положение печени), диафрагмальная грыжа, пневмоперитонеум. Гепатомегалия наблюдается при холестазе и воспалении желчных путей (закупорка камнем, опухолью, паразитом, атрезии желчных путей, холангит и др.). Поделитесь этой записью или добавьте в закладки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Главная
Главная